Camzyos(mavacamten) 는 성인의 증상성 폐쇄성 비대성 심근병(oHCM)을 치료하기 위해 특별히 고안된 새로운 약물입니다.
현재 이해와 임상 데이터를 기반으로 한 자세한 개요는 다음과 같습니다.
성분 및 작용 기전
Camzyos에는 심장 미오신 억제제인 마바캄텐이 들어 있습니다 . 심장 근육 수축에 필수적인 심장 근육 세포의 운동 단백질인 미오신의 활동을 조절하여 작용합니다.
마바캄텐은 미오신에 결합하여 액틴과 결합하는
능력을 감소시켜 oHCM에서 나타나는 과도한 심장 수축을 줄이고 심장 박동 중 더 효과적인 이완 단계를 허용합니다.
Camzyos는 심장 근육 비후 증상으로 인해 정상적인 혈류가 방해를 받아 신체 활동에 약간의 제한이 있거나 현저한 제한이 나타나는 단계인 NYHA Class II 또는 III oHCM이 있는 성인에게 사용이 승인되었습니다.
임상 결과 및 장점
임상 시험, 특히 EXPLORER-HCM 및 VALOR-HCM 연구에서 Camzyos는 위약에 비해 증상과 운동 능력을 상당히 개선했습니다.
좌심실에서 혈류의 막힘을 줄이고, 중격 감소 요법과 같은 더 침습적인 치료의 필요성을 줄이며, oHCM 환자의 삶의 질 측정을 개선하는 것으로 나타났습니다.
기존 치료법과의 비교
증상에 초점을 맞춘 기존 치료법과 달리 Camzyos는 심장 근육 수축성을 직접 조절하여 oHCM의 근본적인 병리생리학을 표적으로 삼습니다.
이 접근 방식은 단순히 증상을 관리하는 것이 아니라 질병의 근본적인 메커니즘을 다루기 때문에 독특합니다.
부작용
Camzyos의 일반적인 부작용으로는 현기증과 실신이 있습니다.
더 심각한 위험으로는 수축 기능에 미치는 영향으로 인한 잠재적인 심부전이 있으며, 따라서 치료 중에 좌심실 박출률(LVEF)을 정기적으로 모니터링해야 합니다.
또한 간 효소에 대한 마바캄텐의 효과로 인해 다른 약물과 상호 작용이 있으며, 이는 약물 수치와 효능을 변경할 수 있습니다.
특별 고려 사항
Camzyos는 그 효과로 인해 심각한 간 기능 장애가 있는 환자에게는 금기이며, 심각한 신장 기능 장애가 있는 환자에게는 주의가 필요합니다.
또한 잠재적인 기형 유발 효과가 있으므로 이점과 위험을 신중하게 고려하지 않고 임산부에게 사용하는 것은 권장되지 않습니다.
전반적으로 Camzyos는 폐쇄성 비대성 심근병 치료에서 상당한 진전을 나타내며, 질병의 심장 수축성 문제를 표적으로 삼는 메커니즘을 통해 기존 치료법보다 이점을 제공합니다.
그러나 부작용에 대한 신중한 모니터링과 관리의 필요성은 안전한 사용에 매우 중요합니다.
Camzyos®(마바캄텐)은 폐쇄성 HCM의 근원을 특별히 표적으로 삼는 유일한 FDA 승인 심장 미오신 억제제입니다.
Camzyos™ (마바캄텐)
개발자
브리스톨-마이어스 스퀴브
치료 수업
심장 미오신 억제제
현재 표시
증상이 있는 뉴욕 심장 협회 2-3급 폐쇄성 비대성 심근병(HCM)
시장 부문
심혈관
확장하다
Camzyos ® (마바캄텐)은 증상성 폐쇄성 비대성 심근병(HCM)을 앓는 성인 환자를 치료하기 위해 미국 식품의약국(FDA)에서 승인한 최초의 심장 미오신 억제제입니다.
이 약은 미국의 바이오제약 회사인 브리스톨-마이어스 스퀴브(BMS)가 개발했으며, 전액 자회사인 마이오카디아(MyoKardia)를 통해 판매됩니다.
생명공학 기업인 LianBio는 2020년 8월 MyoKardia로부터 중국 본토, 홍콩, 마카오, 대만, 태국, 싱가포르에서 해당 약물의 개발 및 마케팅 권리를 인수했습니다.
Camzyos는 2.5mg, 5mg, 10mg, 15mg 캡슐로 판매되며, 다양한 색상의 캡은 약물의 다양한 강도를 나타냅니다.
이 약은 심부전 위험 가능성 때문에 Camzyos REMS PROGRAM이라는 위험 평가 및 완화 전략(REM)에 따른 제한적 프로그램을 통해서만 배포됩니다.
REMS는 특정 약물과 관련된 잠재적인 심각한 안전 문제를 관리하기 위해 FDA가 의무화한 약물 안전 프로그램입니다.
Camzyos에 대한 규제 승인
2022년 4월, FDA는 Camzyos를
뉴욕 심장 협회(NYHA) 2-3급 폐쇄성 HCM 증상이 있는 성인을 치료하여 기능적 능력과 증상을 개선하도록 승인했습니다.
승인은 3상 EXPLORER-HCM 임상 시험의 결과를 기반으로 했습니다.
캠지오스는 폐쇄성 HCM의 근본적인 병태생리를 특별히 표적으로 삼는 최초이자 유일한 FDA 승인 심장 미오신 억제제입니다.
이 약물은 2022년 2월 중국 규제 당국으로부터 폐쇄성 HCM 치료를 위한 획기적 치료제 지정을 받았습니다.
2022년 10월, FDA는 3상 VALOR-HCM 임상 연구의 데이터를 기반으로 중격 축소 요법의 필요성을 줄이기 위해 증상성 폐쇄성 HCM에 대한 라벨을 확장하는 약물에 대한 보충적 신약 신청을 수락했습니다.
Camzyos는 2023년 5월 성인의 증상성 폐쇄성 HCM 치료제로 중국 및 기타 주요 아시아 시장에서 승인되었습니다.
2023년 6월 싱가포르에서 마케팅 승인을 받았습니다.
같은 달, FDA는 3상 VALOR-HCM 연구의 긍정적 데이터를 라벨에 추가하는 것을 승인했습니다.
이 데이터는 Camzyos로 치료받는 환자에서 16주차에 중격 축소술에 대한 가이드라인 기반 적격성의
복합적 종료점에서 유의미한 감소를 보여주었고, 16주차 이전이나 16주차에 중격 축소술을 진행하기로 결정한 경우에도 마찬가지였습니다.
유럽 위원회는 2023년 6월 EXPLORER-HCM 및 VALOR-HCM 임상 시험 결과를 토대로 성인 환자의 증상성 NYHA, II-III급 폐쇄성 HCM 치료제로 이 약물을 승인했습니다.
이 약물은 유럽 연합(EU)에서
승인된 최초의 심장 미오신 억제제입니다.
Camzyos는 모든 EU 회원국에서 심장 미오신에 대해 선택적이며 EU에서 승인한 최초이자 유일한 알로스테릭 및 가역적 억제제입니다.
이 약물은 호주에서도 이 질환에 대해 승인되었습니다.
HCM 원인 및 증상
HCM은 비정상적인 세포 구조와 심장 근육의 두꺼워짐을 유발하는 만성적이고 진행성 질환으로, 신체 부위로의 혈류가 감소합니다.
심장 근육의 과도한 수축과 좌심실 기능 저하가
특징입니다.
폐쇄성 HCM의 경우 심장 벽이 너무 딱딱해지고 뻣뻣해져 심장을 통과하는 혈류가 차단됩니다.
HCM은 전세계적으로 500명 중 1명에게 발병하며, 주로 근절의 근육 단백질을 암호화하는 유전자의 돌연변이로 인해 발생합니다.
HCM 환자는 운동 후 피로나 호흡곤란을 경험하며, 이로 인해 일상 생활 활동을 수행하는 능력이 제한됩니다.
이 상태는 또한 심방세동, 뇌졸중, 심부전 및 갑작스러운 심장사의 위험 증가로
이어질
수 있습니다.
NYHA는 심부전의 정도와 환자의 신체 활동 제한에 따라 HCM을 4가지 범주로 분류합니다.
I 등급으로 분류된 환자는 증상이 나타나지 않으며 걷기, 계단 오르기 등 일반적인 신체 활동을 아무런 제한 없이 수행할 수 있습니다.
2등급 환자는 가벼운 호흡곤란 및/또는 협심증 통증과 일상생활 중 약간의 활동 제한 등 가벼운 증상을 경험합니다.
3등급 환자는 최대 100m의 짧은 거리를 걷는 것과 같은 정상적인 활동에 제한을 받습니다.
이러한 환자는 휴식 시에만 편안함을 느낍니다.
4등급 환자는 심각한 제한을 받으며 휴식 중에도 증상을 호소합니다.
어떤 경우에는 폐쇄성 HCM이 진단되지 않은 채로 남아 있고, 어떤 사람들은 무증상으로 남아 있습니다.
이 상태는 전 세계적으로 400,000~600,000명에게 영향을 미칠 것으로 추정됩니다.
Camzyos의 작용 기전
Camzyos는 액틴에 부착된 미오신 헤드의 수를 조절하여 미오신과 액틴 단백질의 교차 다리 형성을 제어하는 알로스테릭하고 가역적인 억제제입니다.
이 요법은 미오신을 에너지
절약형,
매우 이완된 상태로 이동시켜 작용합니다.
미오신 억제는 동적 좌심실 유출로 폐쇄를 감소시키고 좌심실 충만 압력을 증가시킨다.
Camzyos의 임상 시험
FDA가 Camzyos(mavacamten)를 승인한 것은 위약대조, 다기관, 이중맹검, 무작위 병행군 연구인 3상 시험 EXPLORER-HCM의 데이터를 바탕으로 했습니다.
임상 연구에 따르면 마바캄텐을
투여받은 환자는 위약을 투여받은 환자에 비해 유의미한 개선이 확인되었습니다.
251명의 2급 및 3급 폐쇄성 HCM 환자가 연구에 참여했으며, 그 중 123명은 매일 Camzyos를 투여받았고 나머지는 위약을 투여받았습니다.
참가자들은 30주 동안 하루에 한 번 Camzyos 5mg 또는
위약을
초기 용량으로 투여받도록 무작위로 배정되었습니다.
연구의 1차 종료 지점은 30주차 말에 평가되었으며, 최대 산소 소비량(pVO2)이 최소 1.5ml/kg/min만큼 향상되는 것이었습니다.
Camzyos로 치료받은 환자의 37%, 위약군의 17%가 1차 종료 지점을
충족했습니다.
최소 5%의 환자가 시험 기간 동안 부작용을 목격했습니다.
현기증과 실신(실신)이 참가자들에게 가장 흔하게 관찰된 부작용이었습니다.
Camzyos로 치료받은 환자의 약 27%와 6%가 각각
현기증과
실신을 호소했고, 위약 그룹의 18%와 6%가 각각 동일한 증상을 보고했습니다.
VALOR-HCM 임상 시험 세부 사항
VALOR-HCM은 증상이 있고 폐쇄성 HCM(NYHA 분류 II-IV)을 앓고 있으며 중격 축소술(SRT)에 대한 지침 기준을 충족하고 침습적 시술을 받은 환자를 대상으로 Camzyos의 안전성과 효능을
평가하기 위한 다기관, 무작위, 이중 맹검, 위약 대조 연구였습니다.
이 연구에는 112명의 환자가 등록되었고, 이들은 1:1 비율로 무작위로 배정되어 마바캄텐 또는 위약을 투여받았습니다.
1차 종료점은 16주 전 또는 16주에 SRT를 진행하기로 결정한 환자 비율
또는
16주에 SRT 가이드라인에 따라 적격 상태를 유지한 환자의 비율을 합성한 것입니다.
결과에 따르면, Camzyos로 치료받은 환자의 82%가 수술 시술을 받을 수 없게 되었고 16주 후에 SRT를 진행하지 않기로 결정했습니다.
Camzyos로 치료받은 환자 중 18%만이 16주 전이나 16주에 SRT를 진행하기로 결정했거나 16주에 SRT를 받을 자격이 있는 반면, 위약군 환자의 경우 77%가 SRT를 받을 자격이 있었습니다.
이
연구에서는
부작용이 발견되지 않았습니다.
패키지 인서트 / 제품 라벨
일반 이름: 마바캄텐
투여 형태: 캡슐, 젤라틴 코팅
약물 분류: 기타 심혈관제
Drugs.com에서 의학적으로 검토 . 마지막 업데이트 2024년 5월 16일.
이 페이지에서
- 적응증 및 사용법
- 용량 및 투여
- 복용 형태 및 강도
- 금기사항
- 경고 및 예방 조치
- 부작용/부작용
- 약물 상호 작용
- 특정 인구에서의 사용
- 과다복용
- 설명
- 임상약리학
- 비임상 독성학
- 임상 연구
- 공급/보관 및 취급 방법
- 환자 상담 정보
- 약물 가이드
처방 정보의 하이라이트
CAMZYOS에 대한 전체 처방 정보를 참조하세요. 경구용
CAMZYOS ®
(mavacamten) 캡슐 최초 미국 승인: 2022
경고: 심부전 위험
전체 박스형 경고에 대한 전체 처방 정보를 참조하세요.
( 5.1 )
( 2.1 , 5.1 )
( 4 , 5.2 , 7 )
( 5.3 )
최근 주요 변경 사항
|
경고 및 예방 조치, 심부전( 5.1 ) |
06/2023 |
|
경고 및 예방 조치, 배아-태아 독성( 5.4 ) |
04/2024 |
Camzyos의 적응증 및 사용법
CAMZYOS는 성인의 증상성 뉴욕 심장 협회(NYHA) II-III급 폐쇄성 비대성 심근병(HCM) 치료에 적응된 심장 미오신 억제제로 기능적 능력과 증상을 개선합니다.
( 1 )
Camzyos 복용량 및 투여
복용량은 임상 상태와 환자 반응에 대한 심초음파 평가에 따라 개별화해야 합니다.
지침은 전체 처방 정보( 2.1 ) 를 참조하십시오.
복용 형태 및 강도
캡슐 : 2.5mg, 5mg, 10mg, 15mg( 3 )
금기사항
경고 및 예방 조치
생식 가능성이 있는 여성에게 마지막 복용 후 4개월까지 효과적인 피임법을 사용하도록 조언하십시오. 노르에틴드론이 아닌 프로게스틴을 함유한 복합 호르몬 피임약과 병용 사용을 피하십시오. ( 5.4 , 7.2 , 8.1 , 8.3 )
부작용/부작용
CAMZYOS를 투여받은 환자의 5% 이상에서 발생했으며 위약 투여군보다 더 흔하게 나타난 이상 반응은 현기증(27%)과 실신(6%)이었습니다.
( 6.1 )
의심되는 부작용을 보고하려면 1-800-721-5072로 Bristol-Myers Squibb에 연락하거나 1-800-FDA-1088 또는 www.fda.gov/medwatch로 FDA에 연락하세요.
약물 상호 작용
억제제를 시작하는 경우 CAMZYOS 용량 감소 및 추가 모니터링이 필요합니다.
( 2.2 , 7.1 )
특정 음성 이노트로프 조합은 피하십시오. ( 7.2 )
환자 상담 정보 및 약물 가이드는 17을 참조하십시오.
개정: 4/2024
전체 처방 정보
경고: 심부전 위험
CAMZYOS는 좌심실 박출률(LVEF)을 감소시키고 수축 기능 장애로 인한 심부전을 유발할 수 있습니다 . [ 경고 및 주의사항(5.1) 참조 ]
CAMZYOS 치료 전과 치료 중에 LVEF의 심초음파 평가가 필요합니다.
LVEF가 55% 미만인 환자에게 CAMZYOS를 시작하는 것은 권장되지 않습니다.
방문 시 LVEF가 50% 미만이거나 환자가 심부전 증상이나
임상 상태
악화를 경험하는 경우 CAMZYOS를 중단합니다.
[ 투여량 및 투여(2.1) 및 경고 및 주의사항(5.1) 참조 ] .
특정 시토크롬 P450 억제제와 CAMZYOS를 동시에 사용하거나 특정 시토크롬 P450 유도제를 중단하면 수축 기능 장애로 인한 심부전 위험이 증가할 수 있으므로 다음과 같은 경우에는 CAMZYOS를 사용하는 것이
금기입니다.
[ 금기증(4) 및 경고 및 주의사항(5.2) 참조 ] :
수축 기능 장애로 인한 심부전 위험 때문에 CAMZYOS는 CAMZYOS REMS PROGRAM이라는 위험 평가 및 완화 전략(REMS)에 따른 제한된 프로그램을 통해서만 제공됩니다 . [ 경고 및 주의사항(5.3) 참조]
1. Camzyos의 적응증 및 사용법
2. Camzyos 복용량 및 투여
2.1 치료의 시작, 유지 및 중단
생식 잠재력이 있는 여성에게 임신이 이루어지지 않았는지와 효과적인 피임법을 사용했는지 확인하십시오 . [ 경고 및 주의사항(5.4) 참조 ]
LVEF <55%인 환자에게 CAMZYOS의 투여를 시작하거나 적정량을 증가시키는 것은 권장되지 않습니다.
권장 시작 용량은 음식과 관계없이 1일 1회 경구 5mg입니다.
적정을 통한 허용 가능한 후속 용량은 1일 1회 경구 2.5mg, 5mg, 10mg 또는 15mg입니다.
최대 권장 용량은 1일 1회 경구 15mg입니다.
환자는 CAMZYOS를 복용하는 동안 심부전을 일으킬 수 있습니다.
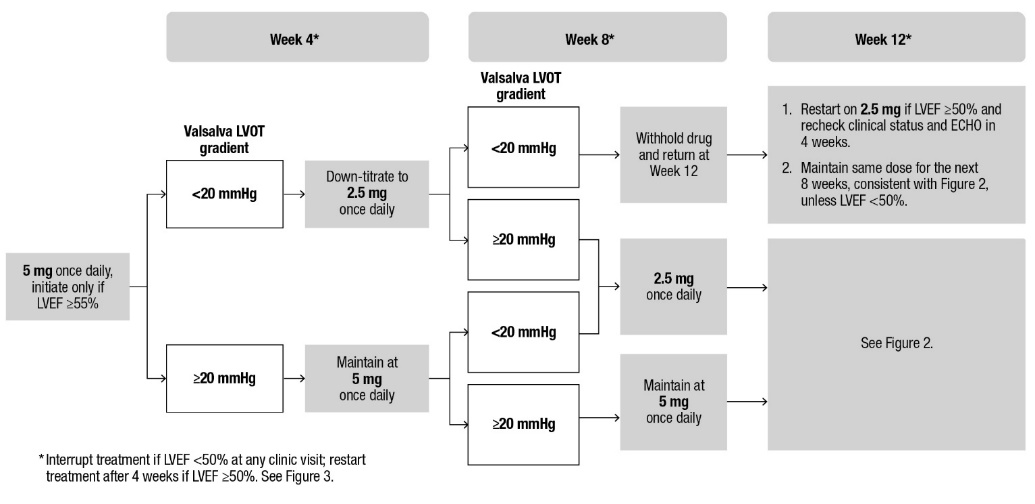
적절한 목표 Valsalva LVOT 기울기를 달성하고 LVEF ≥50%를 유지하며 심부전 증상을 피하기 위해 주의 깊게 적정하려면 정기적인 LVEF 및 Valsalva 좌심실 유출로(LVOT) 기울기 평가가 필요합니다(그림 1 및 그림 2 참조).
매일 복용하면 안정 상태의 약물 수치와 치료 효과에 도달하는 데 몇 주가 걸리며, 대사와 약물 상호작용의 유전적 변이로 인해 노출에 큰 차이가 생길 수 있습니다.
[ 박스형 경고 , 금기사항(4) , 경고 및 주의사항(5.2) , 약물 상호작용(7.1) 및 임상 약리학(12.3) 참조 ] .
CAMZYOS를 시작하거나 적정할 때는 먼저 LVEF를 고려한 다음 Valsalva LVOT 기울기와 환자의 임상 상태를 고려하여 적절한 CAMZYOS 투여량을 안내합니다.
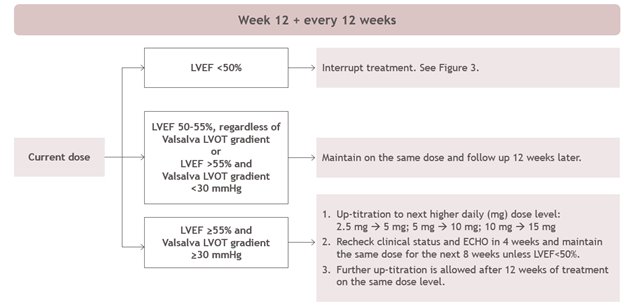
적절한 CAMZYOS 투여 및 모니터링 일정을 위해 시작(그림 1) 및 유지(그림 2) 알고리즘을 따릅니다.
CAMZYOS 복용 중 LVEF <50%인 경우 치료를 중단합니다.
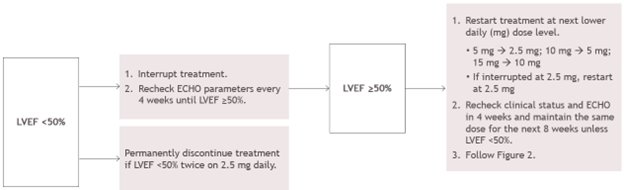
CAMZYOS 중단, 재시작 또는 중단에 대한 지침은 중단 알고리즘(그림 3)을 따릅니다.
2.5mg에서 중단된 경우 2.5mg에서 재시작하거나 영구적으로 중단합니다.
그림 1: 시작 단계
그림 2: 유지 관리 단계
그림 3: LVEF <50%인 경우 모든 진료소 방문 시 치료 중단
동시 질환(예: 심각한 감염)이나 수축 기능을 손상시킬 수 있는 부정맥(예: 심방세동 또는 기타 조절되지 않는 빈맥성 부정맥)이 있는 경우 지연 투여량을 증가시킵니다.
동시 질환이 있는 환자에게는 CAMZYOS 중단을 고려하십시오. [ 경고 및 주의사항(5.1) 참조 ]
복용을 놓치거나 지연한 경우
복용을 놓친 경우 가능한 한 빨리 복용해야 하며, 다음 예정된 복용량은 다음 날 평소 시간에 복용해야 합니다.
하루 중 정확한 복용 시간은 필수가 아니지만, 같은 날에 두 번 복용해서는 안 됩니다.
캡슐을 통째로 삼키십시오. 캡슐을 깨거나, 열거나, 씹지 마십시오.
2.2 약한 CYP2C19 또는 중간 CYP3A4 억제제의 동시 투여
약한 CYP2C19 억제제 또는 중등도 CYP3A4 억제제로 안정적으로 치료를 받고 있는 환자에게는 권장 초기 용량인 1일 1회 경구 5mg으로 CAMZYOS를 투여를 시작합니다.
약한 CYP2C19 억제제 또는 중등도 CYP3A4 억제제를 시작하는 환자의 경우 CAMZYOS의 용량을 한 단계 줄입니다(예: 15mg → 10mg; 10mg → 5mg; 또는 5mg → 2.5mg). 억제제 시작 후 4주 후에 임상 및 심초음파 평가를 예약하고 억제제 시작 후 12주가 지나기 전까지 CAMZYOS를 상향 조정하지 마십시오. 2.5mg의 CAMZYOS로 안정적으로 치료를 받고 있는 환자의 경우 약한 CYP2C19 억제제와 중등도 CYP3A4 억제제를 동시에 시작하는 것은 피하십시오. 더 낮은 CAMZYOS 1일 1회 용량이 없기 때문입니다 [ 용량 및 투여(2.1) , 약물 상호 작용(7.1) 참조 ] .
3. 복용 형태 및 강도
4. 금기사항
5. 경고 및 예방 조치
5.1 심부전
CAMZYOS는 수축기 수축을 감소시키고 심부전을 일으키거나 심실 기능을 완전히 차단할 수 있습니다.
심각한 병발 질환(예: 심각한 감염)이나 부정맥(예: 심방세동 또는 기타 통제되지 않는 빈맥성 부정맥)을 경험하는 환자는 수축기 기능 장애 및 심부전을 일으킬 위험이 더 큽니다 [ 임상 시험 경험(6.1) 참조 ] .
치료 전과 치료 중에 환자의 임상 상태와 LVEF를 정기적으로 평가하고 그에 따라 CAMZYOS 용량을 조절하십시오 [ 용량 및 투여(2.1) 참조 ] . 새로운 또는 악화되는 부정맥, 호흡곤란, 흉통, 피로, 심계항진, 다리 부종 또는 N-말단 프로-B형 나트륨이뇨펩타이드(NT-proBNP) 상승은 심부전의 징후
및 증상일 수 있으며 심장 기능 평가도 실시해야 합니다.
무증상 LVEF 감소, 동반 질환 및 부정맥은 추가적인 투여량 고려가 필요합니다 . [ 투여량 및 투여법(2.1 , 2.2 ) 참조 ]
LVEF <55%인 환자에서 CAMZYOS의 시작은 권장되지 않습니다.
베타 차단제와 함께 디소피라미드, 라놀라진, 베라파밀 또는 베타 차단제와 함께 딜티아젬을 복용하는 환자에서 CAMZYOS의
동시 사용을 피하십시오. 이러한 약물과 조합은 좌심실 수축 기능 장애 및 심부전 증상의 위험을 증가시키고 임상 경험이 제한적입니다 . [ 약물 상호 작용(7) 참조 ].
5.2 CYP450 약물 상호작용으로 인한 심부전 또는 효과 상실
CAMZYOS는 주로 CYP2C19 및 CYP3A4 효소에 의해 대사됩니다.
CAMZYOS와 이러한 효소와 상호 작용하는 약물을 동시에 사용하면 심부전이나 효과 상실과 같은 생명을 위협하는 약물 상호 작용이 발생할 수 있습니다 [ 금기증(4) , 경고 및 주의사항(5.1) , 약물 상호 작용(7.1) 참조 ] .
환자에게 오메프라졸, 에소메프라졸 또는 시메티딘과 같은 일반 의약품을 포함하여 약물 상호작용의 가능성에 대해 알리십시오. 환자에게 CAMZYOS 치료 전과 치료 중에 모든 병용 제품에 대해 의료 서비스 제공자에게 알리도록 알리십시오 [ 약물 상호작용(7.1) , 환자 상담 정보(17) 참조 ] .
5.3 CAMZYOS REMS 프로그램
자세한 내용은 www.CAMZYOSREMS.com에서 확인하거나 1-833-628-7367로 전화해 문의하세요.
5.4 배아-태아 독성
동물 연구 결과에 따르면, CAMZYOS는 임신한 여성에게 투여 시 태아 독성을 일으킬 수 있습니다.
치료 전에 생식 가능성이 있는 여성의 임신이 없음을 확인하고 환자에게 CAMZYOS 치료 중과 마지막 복용 후 4개월 동안 효과적인 피임법을 사용하도록 조언하십시오. 에티닐에스트라디올과 노르에틴드론의
조합을 함유한 CHC는 마바캄텐과 함께 사용할 수 있습니다.
그러나 CAMZYOS는 특정 다른 복합 호르몬 피임법(CHC)의 효과를 감소시킬 수 있습니다.
이러한 CHC를 사용하는 경우 환자에게 CAMZYOS와 병용 사용하는 동안과 마지막 복용 후 4개월 동안 비호르몬 피임법(예: 콘돔)을 추가하도록 조언하십시오 [ 약물 상호 작용(7.2) 및 특정 집단에서의 사용(8.1 , 8.3 ) 참조] .
6. 부작용/부작용
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되기 때문에 약물의 임상 시험에서 관찰된 부작용 발생률을 다른 약물의 임상 시험 발생률과 직접 비교할 수 없으며, 실제 임상에서 관찰된 발생률을 반영하지 않을 수도 있습니다.
CAMZYOS의 안전성은 3상 이중맹검 무작위 위약대조 시험인 EXPLORER-HCM에서 평가되었습니다 [ 임상 연구 참조(14) ] . 폐쇄성 HCM이 있는 251명의 성인 중 123명의 환자가 CAMZYOS 2.5-15mg을 매일 투여받았고 128명은 위약을 투여받았습니다.
CAMZYOS로 치료받은 환자의 중간
노출
기간은 30주였습니다(범위: 2-40주).
실신(0.8%)은 CAMZYOS를 투여받는 환자에서 투여 중단으로 이어진 유일한 이상반응이었습니다.
CAMZYOS를 투여받은 환자의 5% 이상에서 발생했으며 위약 투여군보다 흔하게 나타난 이상 반응은 현기증(27% 대 18%)과 실신(6% 대 2%)이었습니다.
CAMZYOS의 환자 안전성은 3상 이중맹검 무작위 위약대조 시험인 VALOR-HCM에서 추가로 평가되었습니다 [ 임상 연구 참조(14) ] . 증상이 있는 폐쇄성 HCM이 있는 성인 112명 중 56명의 환자가 CAMZYOS 2.5-15mg을 매일 투여받았고 55명은 위약을 투여받았습니다.
CAMZYOS로 치료받은 환자의
중간 노출 기간은 17주였습니다(범위: 3-19주).
VALOR-HCM에서는 새로운 부작용이 확인되지 않았습니다.
수축 기능에 대한 효과
EXPLORER-HCM 시험에서 평균(SD) 휴식 LVEF는 두 치료군 모두 기준선에서 74%(6)였습니다.
CAMZYOS의 작용 기전과 일관되게, 30주 치료 기간 동안 LVEF의 기준선에서의 평균(SD) 절대 변화량은 CAMZYOS 군에서 -4%(8)이고 위약군에서 0%(7)였습니다.
8주간 시험 약물을 중단한 후 38주차에 두 치료군의 평균 LVEF는 기준선과 유사했습니다.
EXPLORER-HCM 시험에서 CAMZYOS 군에서 7명(6%), 위약군에서 2명(2%)이 치료 중에 LVEF가 <50%(중앙값 48%: 범위 35-49%)로 가역적으로 감소했습니다.
7명의 CAMZYOS 환자 중 3명과 2명의 위약 환자 중 1명에서 이러한 감소는 무증상이었습니다.
CAMZYOS로 치료받은 7명의 환자 모두에서 CAMZYOS 중단 후 LVEF가 회복되었습니다 . [ 경고 및 주의사항(5.1) 참조 ]
7. 약물 상호 작용
7.1 CAMZYOS의 혈장 농도에 영향을 미치는 다른 약물의 가능성
마바캄텐은 주로 CYP2C19에 의해 대사되고, CYP3A4와 CYP2C9에 의해 대사되는 정도는 낮습니다.
CYP2C19의 유도제 및 억제제와 CYP3A4의 중간에서 강한 억제제 또는 유도제는 마바캄텐의 노출에 영향을 미칠 수 있습니다 [ 경고 및 주의사항(5.2) 및 임상 약리학(12.3) 참조 ] . (표 1 참조 )
표 1: CAMZYOS와의 확립된 및 잠재적으로 중요한 약동학적 약물 상호 작용
CAMZYOS에 대한 다른 약물의 영향
|
중간~강력한 CYP2C19 억제제 또는 강력한 CYP3A4 억제제 |
|
|
임상적 영향 |
중간 내지 강력한 CYP2C19 억제제 또는 강력한 CYP3A4 억제제와 동시에 사용하면 마바캄텐 노출이 증가하여 수축 기능 장애로 인한 심부전 위험이 증가할 수 있습니다. |
|
예방 또는 관리 |
중간 정도에서 강력한 CYP2C19 억제제 또는 강력한 CYP3A4 억제제와 동시에 사용하는 것은 금기입니다. |
|
중간에서 강력한 CYP2C19 유도제 또는 중간에서 강력한 CYP3A4 유도제 |
|
|
임상적 영향 |
중간에서 강력한 CYP2C19 유도제 또는 중간에서 강력한 CYP3A4 유도제와 동시에 사용하면 마바캄텐 노출이 감소하여 CAMZYOS의 효능이 감소할 수 있습니다 [ 임상 약리학(12.3) 참조 ] . 유도 효소 수치가 정상화됨에 따라 이러한 유도제 중단으로 인해 수축 기능 장애로 인한 심부전 위험이 증가할 수 있습니다 [ 금기증(4) 및 경고 및 주의사항(5.2) 참조 ] . |
|
예방 또는 관리 |
중간에서 강력한 CYP2C19 유도제 또는 중간에서 강력한 CYP3A4 유도제를 동시에 사용하는 것은 금기입니다. |
|
약한 CYP2C19 억제제 또는 중간 CYP3A4 억제제 |
|
|
임상적 영향 |
약한 CYP2C19 억제제 또는 중간 정도의 CYP3A4 억제제와 동시에 사용하면 마바캄텐 노출이 증가하여 부작용의 위험이 높아질 수 있습니다. |
|
예방 또는 관리 |
약한 CYP2C19 억제제 또는 중등도 CYP3A4 억제제로 안정적으로 치료를 받고 있는 환자에게는 권장 초기 용량인 1일 1회 경구 5mg으로 CAMZYOS를 투여를 시작합니다. CAMZYOS 치료를 받고 있고 약한 CYP2C19 억제제나 중등도 CYP3A4 억제제를 시작할 계획인 환자의 경우 CAMZYOS의 용량을 한 단계(예: 15~10mg, 10~5mg 또는 5~2.5mg)만큼 감량합니다. |
7.2 CAMZYOS가 다른 약물의 혈장 농도에 영향을 미칠 가능성
특정 CYP3A4, CYP2C9 및 CYP2C19 기질
마바캄텐은 CYP3A4, CYP2C9 및 CYP2C19의 유도제입니다.
CYP3A4, CYP2C9 또는 CYP2C19 기질과 병용하면 이러한 약물의 혈장 농도가 감소할 수 있습니다 [ 임상 약리학(12.3) 참조 ]. 처방 정보에서 달리 권장하지 않는 한, CAMZYOS를 CYP3A4, CYP2C9 또는 CYP2C19 기질과 병용하는 경우 주의 깊게 모니터링하십시오.
특정 복합 호르몬 피임약(CHC)
프로게스틴과 에티닐에스트라디올은 CYP3A4 기질입니다.
CAMZYOS를 동시에 사용하면 특정 프로게스틴 노출이 감소할 수 있습니다 [ 임상 약리학(12.3) 참조 ] .
이는 피임 실패로 이어질 수 있습니다.
에티닐에스트라디올과 노르에틴드론의 조합을 함유한 CHC는 마바캄텐과 함께 사용할 수 있지만 다른 CHC를 사용하는 경우 환자에게 CAMZYOS를 동시에 사용하는 동안과 마지막 복용 후 4개월 동안 비호르몬 피임법(예: 콘돔)을 추가하도록 조언하십시오.
7.3 심장 수축력을 감소시키는 약물
CAMZYOS 및 심장 수축력을 감소시키는 다른 약물의 부가적 부정적 이노트로픽 효과를 예상하십시오. 베타 차단제와 함께 디소피라미드, 라놀라진, 베라파밀 또는 베타 차단제와 함께 딜티아젬을 복용하는 환자에게 CAMZYOS를 동시에 사용하는 것은 피하십시오. 이러한 약물과 조합은 좌심실 수축 기능 장애 및 심부전 증상의 위험을 증가시키고 임상 경험이 제한적입니다 . [ 경고 및 주의사항(5.1) 참조 ] .
음성 이노트로프와 병용 치료를 시작하거나 음성 이노트로프의 복용량을 늘린 경우, 안정적인 복용량과 임상적 반응이 나타날 때까지 LVEF를 면밀히 모니터링하세요.
8. 특정 인구에 사용
8.1 임신
위험 요약
동물 데이터에 따르면, CAMZYOS는 임산부에게 투여 시 태아에 해를 끼칠 수 있습니다.
주요 선천적 결함, 유산 또는 기타 모체 또는 태아에 대한 부작용의 약물 관련 위험을 평가하기 위해 임신 중에 CAMZYOS를 사용한 인간 데이터는 없습니다.
임신 중 기저 모체 상태는 모체와 태아에게 위험을 초래합니다 ( 임상 고려 사항 참조 ) . 임신 중 모체가 CAMZYOS에 노출되면 태아에 대한 잠재적 위험에 대해 임산부에게 알리십시오.
동물 배아-태아 발달 연구에서 쥐에서 마바캄텐 관련 태아 체중 감소, 태아 뼈 골화 감소, 이식 후 손실(조기 및/또는 후기 흡수) 증가가 관찰되었고, 최대 권장 인간 복용량(MRHD)에서 달성된 것과 유사한 복용량 노출에서 토끼와 쥐 모두에서 내장 및 골격 기형이 증가하는 것이 관찰되었습니다( 자료 참조 ) .
지정된 인구에 대한 주요 선천적 결함 및 유산의 추정 배경 위험은 알려져 있지 않습니다.
모든 임신에는 선천적 결함, 유산 또는 기타 불리한 결과의 배경 위험이 있습니다.
미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 결함 및 유산의 추정 배경 위험은 각각 2%~4% 및 15%~20%입니다.
CAMZYOS에 대한 임신 안전성 연구가 있습니다.
임신 중에 CAMZYOS를 투여하거나, 환자가 CAMZYOS를 투여하는 동안 또는 CAMZYOS의 마지막 복용 후 4개월 이내에 임신한 경우, 의료 서비스 제공자는 1-800-721-5072 또는 www.bms.com으로 Bristol-Myers Squibb에 연락하여 CAMZYOS 노출을 보고해야 합니다.
질병 관련 모성 및 배아-태아 위험
임신 중 폐쇄성 HCM은 조산 위험 증가와 관련이 있습니다.
동물 데이터
임신 쥐에게 장기 형성 기간 동안 마바캄텐을 경구 투여했을 때(0.3~1.5mg/kg/day), 고용량 그룹(1.5mg/kg/day)에서 착상 후 손실 증가, 태아 평균 체중 감소, 태아 뼈 골화 감소, 태아 기형(장기 및 골격)이 관찰되었습니다.
내장 기형(태아의 심장 기형, 완전한 좌골 역위 1건 포함)과 골격 기형(주로 융합된
흉골)의 발생률 증가가 MRHD에서 인간과 유사한 노출에서 관찰되었습니다.
쥐의 배아-태아 발달에 대한 무효과 용량에서 혈장 노출(농도-시간 곡선 아래의 면적 또는 AUC 기준)은 MRHD에서 인간의 노출의 0.3배입니다.
임신 토끼에게 기관 형성 기간 동안 마바캄텐을 경구 투여했을 때(0.6~2.0mg/kg/일), 태아 기형(장기 및 골격)이 1.2mg/kg/일 이상의 용량에서 증가했으며, 1.2mg/kg/일에서 MRHD에서 인간의 혈장 노출과 유사했습니다.
내장 소견은 대혈관 기형(폐동맥 줄기 및/또는 대동맥궁 확장)으로 구성되었습니다.
골격 기형은
≥1.2mg/kg/일에서 융합된 흉골의 발생률이 더 높았습니다.
토끼의 배아-태아 발달에 대한 무효과 용량에서의 혈장 노출(AUC)은 MRHD에서 인간의 노출의 0.4배입니다.
출산 전/후 발달 연구에서, 마바캄텐은 임신 쥐에게 임신 6일부터 수유/산후 20일까지 경구 투여되었습니다(0.3~1.5mg/kg/일). 태어나기 전부터(자궁 내) 수유 기간까지 매일 노출된 어미 쥐나 새끼에게는 부작용이 관찰되지 않았습니다.
무관찰 부작용 수준(NOAEL)은 1.5mg/kg/일(테스트된 최고 용량 수준)이었고,
MRHD에서 인간과 유사한 노출(AUC)을 보였습니다.
8.2 수유
8.3 생식 잠재력이 있는 여성과 남성
동물 데이터에 따르면 CAMZYOS는 임산부에게 투여 시 태아에게 해를 끼칠 수 있습니다.
[ 경고 및 주의사항(5.4) 및 특정 집단에서의 사용(8.1) 참조 ]
임신 테스트
CAMZYOS 투여를 시작하기 전에 생식 가능성이 있는 여성의 임신이 없음을 확인하십시오.
피임
안
생식 가능성이 있는 여성에게 CAMZYOS 치료 중 및 마지막 복용 후 4개월 동안 효과적인 피임법을 사용하도록 조언하십시오. 에티닐 에스트라디올과 노르에틴드론의 조합을 함유한 CHC는 마바캄텐과 함께 사용할 수 있습니다.
그러나 CAMZYOS는 특정 다른 복합 호르몬 피임법(CHC)의 효과를 감소시킬 수 있습니다.
이러한 CHC를 사용하는 경우 환자에게 CAMZYOS와 병용하는 동안 및 마지막 복용 후 4개월 동안 비호르몬 피임법(예: 콘돔)을 추가하도록 조언하십시오. [ 약물 상호 작용(7.2) 참조 ] .
8.4 소아 사용
8.5 노인 사용
8.6 간 기능 장애
10. 과다복용
관리
11. Camzyos 설명
경구용 CAMZYOS 캡슐에는 심장 미오신 억제제인 마바캄텐이 함유되어 있습니다.
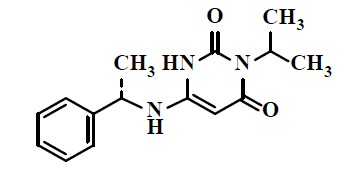
마바캄텐의 화학명은 3-(1-메틸에틸)-6-[[(1S)-1-페닐에틸]아미노]-2,4(1H , 3H ) - 피리 미딘 디온 입니다 . 분자식은 C15H19N3O2이고 , 분자량은 273.33g/mol입니다 .
마바캄텐의 구조식은 다음과 같다.
마바캄텐은 흰색에서 거의 흰색에 가까운 분말로, pH 2~10의 물과 수용액에 거의 녹지 않고, 메탄올과 에탄올에는 거의 녹지 않으며, DMSO와 NMP에는 잘 녹습니다.
CAMZYOS는 즉시 방출되는 2호 경질 젤라틴 캡슐로 제공되며, 활성 성분으로 캡슐당 2.5mg, 5mg, 10mg 또는 15mg의 마바캄텐과 다음의 비활성 성분을 함유합니다: 크로스카멜로스 나트륨, 히프로멜로스, 스테아르산 마그네슘(비소), 만니톨 및 이산화규소. 캡슐 껍질에는 검은색 식용 잉크, 검은색 산화철, 젤라틴, 적색
산화철, 이산화티타늄 및 황색 산화철이 포함되어 있습니다.
12. Camzyos - 임상 약리학
12.1 작용 기전
12.2 약력학
좌심실 박출률 및 좌심실 유출로 폐쇄
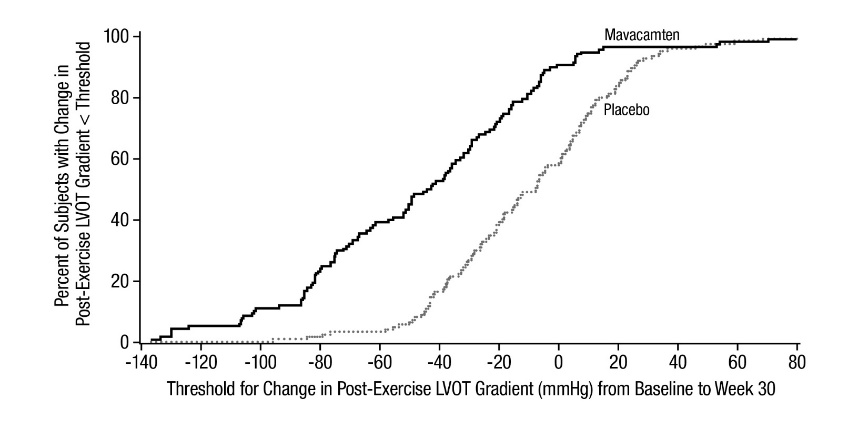
EXPLORER-HCM 시험에서 환자들은 4주차까지 평균 휴식 및 유발(Valsalva) LVOT 기울기가 감소했으며, 이는 30주 시험 내내 유지되었습니다.
30주차에 휴식 및 Valsalva LVOT 기울기의 기준선으로부터의 평균(SD) 변화는 CAMZYOS 그룹의 경우 각각 -39(29)mmHg 및 -49(34)mmHg였고 위약 그룹의 경우 각각 -6(28)mmHg
및 -12(31)mmHg였습니다.
Valsalva LVOT 기울기 감소는 일반적으로 정상 범위 내의 LVEF 감소를 동반했습니다.
CAMZYOS 중단 8주 후에 평균 LVEF 및 Valsalva LVOT 기울기는 기준선과 유사했습니다.
심장 구조
EXPLORER-HCM에서 심장 구조에 대한 심초음파 측정 결과, 마바캄텐군의 좌심실 질량 지수(LVMI)가 기준선에서 30주차에 평균(SD) 감소한 것으로 나타났습니다(-7.4[17.8] g/m 2 ). 반면 위약군의 LVMI는 증가했습니다(8.9[15.3] g/m 2 ).
또한 마바캄텐군의 좌심방 용적 지수(LAVI)도 기준선에서 평균(SD) 감소했습니다(-7.5[7.8] mL/m 2 ). 반면 위약군은 변화가 없었습니다(-0.1[8.7] mL/m 2 ). 이러한 결과의 임상적 유의성은 알려져 있지 않습니다.
심장 바이오마커
EXPLORER-HCM 시험 [ 임상 연구 참조(14) ] 에서 심장벽 스트레스의 바이오마커인 NT-proBNP의 감소가 4주차에 관찰되었으며 치료 종료 시까지 지속되었습니다.
기준선과 비교하여 30주차에 마바캄텐 치료 후 NT-proBNP 감소는 위약보다 80% 더 컸습니다(두 그룹 간
기하
평균 비율, 0.20 [95% CI: 0.17, 0.24]).
VALOR-HCM 시험 [ 임상 연구 참조(14) ] 에서 NT-proBNP 감소는 8주차에 관찰되었고 치료 내내 지속되었습니다.
기준선과 비교하여 16주차에 마바캄텐 치료 후 NT-proBNP 감소는 위약보다 67% 더 컸습니다(두 그룹 간 기하 평균 비율의 비율, 0.33 [95% CI: 0.27,
0.42]).
기준선과 비교하여 16주차에 마바캄텐 치료 후 심장 트로포닌 I 감소는 위약보다 47% 더 컸습니다(두 그룹 간 기하 평균 비율의 비율, 0.53 [95% CI: 0.41, 0.70]).
NT-proBNP와 트로포닌 결과의 임상적 중요성은 알려져 있지 않습니다.
심장 전기 생리학
건강한 자원봉사자에게 CAMZYOS를 여러 번 투여한 결과, 1일 1회 최대 25mg의 용량에서 농도 의존적으로 QTc 간격이 증가하는 것으로 관찰되었습니다.
단일 용량 연구에서 유사한 노출에서 급성 QTc 변화는 관찰되지 않았습니다.
QT 연장 효과의 메커니즘은 알려져 있지 않습니다.
HCM 환자를 대상으로 한 임상 연구의 메타 분석은 치료 노출 범위에서 QTc 간격의 임상적으로 관련성 있는 증가를 시사하지 않습니다.
HCM에서 QT 간격은 기저 질환, 심실 조율과 관련하여 또는 HCM 집단에서 일반적으로 사용되는 QT 연장 가능성이 있는 약물과 관련하여 본질적으로 연장될 수 있습니다.
CAMZYOS를
다른 QT 연장 약물과 함께 투여하거나 칼륨 채널 변형으로 인해 QT 간격이 길어지는 환자의 경우의 효과는 특성화되지 않았습니다.
12.3 약동학
마바캄텐 노출은 1mg에서 15mg의 일일 1회 복용량을 여러 번 투여한 후 복용량에 비례하여 증가합니다.
CAMZYOS의 동일한 복용량 수준에서 건강한 대상자에 비해 HCM 환자는 마바캄텐 노출량이 170% 더 높습니다.
마바캄텐 축적은 CYP2C19 정상 대사자(NM)에서 Cmax의 경우 약 100%, AUC의
경우 약
600%입니다 . 축적은 CYP2C19 대사 상태에 따라 달라지며, 가장 큰 축적은 CYP2C19 대사 불량자(PM)에서 발생합니다.
정상 상태에서 일일 1회 복용 시 마바캄텐 혈장 농도의 피크 대 저점 비율은 약 1.5입니다.
흡수
마바캄텐의 경구 생체이용률은 최소 85%로 추산되며 최대 농도에 이르는 중간 시간(Tmax ) 은 1~2시간입니다.
음식의 효과
고지방 식사와 함께 마바캄텐을 투여한 경우 임상적으로 유의미한 AUC 차이는 관찰되지 않았습니다.
분포
마바캄텐의 혈장 단백질 결합률은 97~98%이다.
제거
마바캄텐은 CYP2C19 대사 상태에 따라 달라지는 가변적인 말단 t 1/2를 가지고 있습니다 . 마바캄텐 말단 반감기는 CYP2C19 정상 대사자(NM)에서 6~9일이고, CYP2C19 불량 대사자(PM)에서는 23일까지 연장됩니다.
대사
마바캄텐은 주로 CYP2C19(74%), CYP3A4(18%), CYP2C9(8%)를 통해 광범위하게 대사됩니다.
배설
방사성 표지된 마바캄텐 25mg을 단회 투여한 후, 투여량의 7%가 대변에서 회수되었고(1%는 변화 없음), 85%가 소변에서 회수되었습니다(3%는 변화 없음).
특정 인구
마바캄텐의 약동학에서 임상적으로 유의한 차이는 나이(범위: 18-82세), 성별, 인종, 민족 또는 경증(eGFR: 60~89 mL/min/1.73 m 2 )에서 중등도(eGFR: 30~59 mL/min/1.73 m 2 ) 신장 장애에 따라 관찰되지 않았습니다.
중증(eGFR: 15~30
mL/min/1.73
m 2 ) 신장 장애 및 신부전(eGFR: <15 mL/min/1.73 m 2 ; 투석 환자 포함)의 영향은 알려져 있지 않습니다.
간 기능 장애
마바캄텐 노출(AUC)은 경증(Child-Pugh A) 또는 중등도(Child-Pugh B) 간 손상 환자에서 최대 220% 증가했습니다.
중증(Child-Pugh C) 간 손상의 영향은 알려져 있지 않습니다.
약물 상호 작용
임상 연구 및 모델 기반 접근 방식
약한 CYP2C19 억제제: 마바캄텐(15mg)과 오메프라졸(20mg)을 하루 한 번 동시 투여한 결과, 건강한 CYP2C19 NM 환자와 빠른 대사자(RM, 예: *1/*17)에서 마바캄텐 AUC inf가 48% 증가했으며 Cmax 에는 영향이 없었습니다 .
중간 CYP3A4 억제제: 마바캄텐(25mg)과 베라파밀 지속 방출(240mg)을 병용 투여하면 중간 대사자(IMs; 예: *1/*2, *1/*3, *2/*17, *3/*17)와 CYP2C19의 NM에서 마바캄텐 AUC inf 가 16%, Cmax 가 52% 증가했습니다.
CYP2C19 PM에서 딜티아젬과 마바캄텐을 병용 투여하면 마바캄텐 AUC 0-24h 와 Cmax 가 각각 최대 55%와 42% 증가할 것으로 예상됩니다.
강력한 CYP3A4 억제제: 마바캄텐(15mg)과 케토코나졸 400mg을 하루 한 번 병용 투여할 경우 마바캄텐 AUC 0-24 와 Cmax 가 각각 최대 130%와 90%까지 증가할
것으로 예상됩니다.
강력한 CYP2C19 및 CYP3A4 유도제: 마바캄텐(단일 15mg 투여)과 강력한 CYP2C19 및 CYP3A4 유도제(리팜핀 600mg 일일 투여)를 병용 투여할 경우 CYP2C19 NM에서는 마바캄텐 AUC 0-inf 및 Cmax 가 각각 87% 및 22% 감소하고, CYP2C19 PM에서는 각각 69% 및 4% 감소하는 것으로 예측됩니다.
CYP3A4 기질: 16일 동안 마바캄텐(1일차와 2일차에 25mg, 그 후 14일 동안 15mg)을 병용 투여하면 건강한 대상자에서 미다졸람의 AUC inf 와 Cmax 가 각각 13%와
7% 감소했습니다.
치료 범위의 상한에 있는 HCM 환자에게 마바캄텐을 1일 1회 병용 투여한 후, 미다졸람의 AUC inf 와 Cmax 가 각각 최대 45%와 24% 감소할 것으로 예상됩니다.
특정 복합 경구 피임약: CYP2C19 NM 표현형을 가진 건강한 여성 피험자에서 에티닐 에스트라디올과 노르에틴드론이 함유된 복합 경구 피임약과 마바캄텐 17일 코스(1일차와 2일차에 25mg, 그 후 15일차에 15mg)를 동시에 사용한 후 에티닐 에스트라디올과
노르에틴드론 노출에 임상적으로 유의미한 차이가 관찰되지 않았습니다.
마바캄텐이 다른 프로게스틴이 함유된 경구 피임약에 미치는 영향은 알려져 있지 않습니다.
CYP2C8 기질: HCM 환자에게 마바캄텐을 하루에 한 번 병용 투여할 경우 CYP2C8과 CYP3A 기질인 레파글리나이드의 AUC와 Cmax 가 마바캄텐의 복용량과 CYP2C19 표현형에 따라 각각 최대 27%와 19%까지 감소할 것으로 예측됩니다.
CYP2C9 기질: HCM 환자에게 마바캄텐을 하루에 한 번 병용 투여할 경우 CYP2C9 기질인 톨부타미드의 AUC와 Cmax 가 마바캄텐의 복용량과 CYP2C19 표현형에 따라 각각 최대 54%와 23%까지 감소할 것으로 예측됩니다.
CYP2C19 기질: HCM 환자에게 마바캄텐을 하루에 한 번 병용 투여할 경우 CYP2C19 기질인 오메프라졸의 AUC와 Cmax 가 마바캄텐의 복용량과 CYP2C19 표현형에 따라 각각 최대 48%와 17%까지 감소할 것으로 예측됩니다.
활성탄: 마바캄텐 AUC 0-72h 및 AUC 0-무한대는 마바캄텐 15mg 단일 복용량 섭취 2시간 후에 소르비톨과 함께 활성탄 50g을 투여한 후 각각 14% 및 34% 감소했습니다.
마바캄텐 복용 6시간 후에 활성탄을 투여한 경우 마바캄텐 노출에 미치는 영향이 미미했습니다.
체외 연구
CYP 효소: 마바캄텐은 CYP1A2, CYP2B6, CYP2C8, CYP2D6, CYP2C9, CYP2C19 또는 CYP3A4를 억제하지 않습니다.
마바캄텐은 CYP2B6 유도제입니다.
수송체 시스템: 마바캄텐은 P-gp, BCRP, BSEP, MATE1, MATE2-K, 유기 음이온 수송 폴리펩티드(OATP), 유기 양이온 수송체(OCT), 또는 유기 음이온 수송체(OAT)를 억제하지 않습니다.
12.5 약리유전학
CYP2C19 불량 대사자(PM)에서 15mg의 마바캄텐을 단회 투여한 후 정상 대사자(NM)에 비해 마바캄텐 AUC inf가 241% 증가하고 Cmax 가 47% 증가했습니다.
CYP2C19 PM에서 NM에 비해 평균 반감기가 길어졌습니다(각각
23일 대 6~9일).
다형성 CYP2C19는 CAMZYOS 대사에 관여하는 주요 효소입니다.
두 개의 정상 기능 대립유전자를 가진 개인은 NM(예: *1/*1)입니다.
두 개의 비기능 대립유전자를 가진 개인은 PM(예: *2/*2, *2/*3, *3/*3)입니다.
CYP2C19 불량 대사자의 유병률은 조상에 따라 다릅니다.
유럽 조상의 약 2%와 아프리카 조상의 약 4%가 PM입니다.
PM의 유병률은 아시아 인구에서 더 높습니다(예: 동아시아인의 약 13%).
13. 비임상 독성학
13.1 발암, 돌연변이 및 생식 능력 손상
마바캄텐은 박테리아 역돌연변이 시험(에임스 시험), 인간 시험관 내 림프구 염색체 이상 시험 또는 쥐 생체 내 미소핵 시험에서 유전독성을 나타내지 않았습니다.
수컷의 경우 최대 2.0mg/kg/일, 암컷의 경우 최대 3.0mg/kg/일의 마바캄텐 복용량에서 6개월 rasH2 형질전환 마우스 연구나, 2년 랫드의 경우 최대 0.6mg/kg/일의 마바캄텐 복용량에서 발암성 증거는 발견되지 않았습니다.
마우스와 래트의 노출 기반(AUC) 안전 마진은 MRHD에서 인간의 AUC 노출과 비교했을
때
각각 최대 3배 또는 0.2배였습니다.
생식 독성 연구에서, 최대 1.2mg/kg/day의 용량에서 수컷 또는 암컷 쥐의 교미 및 생식력에 대한 마바캄텐의 효과나 최대 1.5mg/kg/day의 용량에서 암컷 새끼의 생존력 및 생식력에 대한 효과가 입증되지 않았습니다.
시험된 최고 용량에서 마바캄텐의 혈장 노출(AUC)은 MRHD에서 인간과 동일했습니다.
13.2 동물 독성학 및/또는 약리학
14. 임상 연구
익스플로러-HCM
CAMZYOS의 효능은 251명의 성인을 대상으로 한 3상 이중맹검 무작위 위약대조 다기관 국제 병행군 시험인 EXPLORER-HCM(NCT-03470545)에서 평가되었습니다.
이 시험은 NYHA II 및 III 등급의 증상이 있는 폐쇄성 HCM, LVEF ≥55%, 휴식 시 또는 자극 시 LVOT 최대 기울기 ≥50 mmHg를 앓고 있는 환자를 대상으로
실시되었습니다.
베타 차단제와 칼슘 채널 차단제 치료의 이중 요법 또는 디소피라미드나 라놀라진의 단일 요법을 받는 환자는 제외되었습니다.
파브리병, 아밀로이드증 또는 좌심실 비대가 있는 누난 증후군과 같이 폐쇄성 HCM을 모방하는 심장 비대를 유발하는 알려진 침윤성 또는 저장 장애가 있는 환자도 제외되었습니다.
환자들은 1:1 비율로 무작위로 배정되어 30주 동안 매일 한 번 CAMZYOS 5mg의 시작 용량 또는 위약을 투여받았습니다.
치료 배정은 기준 NYHA 기능 클래스, 기준 베타 차단제 사용, 에르고미터 유형(러닝머신 또는 운동용 자전거)에 따라 계층화되었습니다.
그룹은 나이(평균 59세), BMI(평균 30 kg/m 2 ), 심박수(평균 62 bpm), 혈압(평균 128/76 mmHg), 인종(90% 백인) 에 있어서 잘 일치했습니다 . 남성은 CAMZYOS 그룹의 54%, 위약 그룹의 65%를 차지했습니다.
기준선에서 무작위로 배정된 환자의 약 73%가 NYHA 2등급이었고 27%가 NYHA 3등급이었습니다.
평균 LVEF는 74%였고 평균 Valsalva LVOT 기울기는 73mmHg였습니다.
약 10%가 이전에 중격 감소 치료를 받았고, 75%가 베타 차단제를 사용했고, 17%가 칼슘 채널 차단제를 사용했고, 14%가 심방 세동의 병력이 있었습니다.
모든 환자는 CAMZYOS 5mg(또는 일치하는 위약)을 매일 한 번 복용하기 시작했으며, 용량은 환자 반응을 최적화(발살바 기동으로 인한 LVOT 기울기 감소)하고 LVEF ≥50%를 유지하기 위해 주기적으로 조절되었습니다.
용량은 또한 CAMZYOS의 혈장 농도에 따라 결정되었습니다.
CAMZYOS 그룹에서 치료 종료 시 환자의 49%가 5mg 용량을, 33%가 10mg 용량을, 11%가 15mg 용량을 투여받고 있었습니다.
3명의 환자가 LVEF <50%로 인해 일시적으로 복용을 중단했고, 그 중 2명은 동일한 용량으로 치료를 재개했고 1명은 10mg에서 5mg으로 용량을 줄였습니다.
1차 종료점
30주차에 평가한 1차 복합 기능적 종료점은 최대 산소 소비량(pVO2)이 ≥1.5 mL/kg/min 향상 되고 NYHA 분류가 최소 1% 향상되거나 pVO2가 ≥3.0 mL/kg/min 향상되고 NYHA 분류가 악화되지 않는 환자의 비율로 정의했습니다.
CAMZYOS 그룹에서 30주차에 1차 종료 지점을 충족한 환자의 비율이 위약 그룹보다 더 높았습니다(각각 37% 대 17%, p=0.0005, 표 2 참조).
|
캠시오스 N (%) 숫자 = 123 |
위약 N (%) 숫자 = 128 |
차이점 (95% 신뢰구간) |
p-값 |
|
|
총 응답자 수 |
45(37%) |
22 (17%) |
19% (9, 30) |
0.0005 |
|
기준선에서의 변경 pVO2 ≥1.5 mL /kg/min 및 NYHA 감소 |
41 (33%) |
18 (14%) |
19% (9, 30) |
|
|
기준선에서의 변경 pVO2 ≥3 mL /kg/min 및 NYHA 증가하지 않음 |
29 (23%) |
14(11%) |
13% (3, 22) |
다양한 인구학적 특성, 기준 질병 특성 및 기준 수반 약물이 결과에 미치는 영향을 조사했습니다.
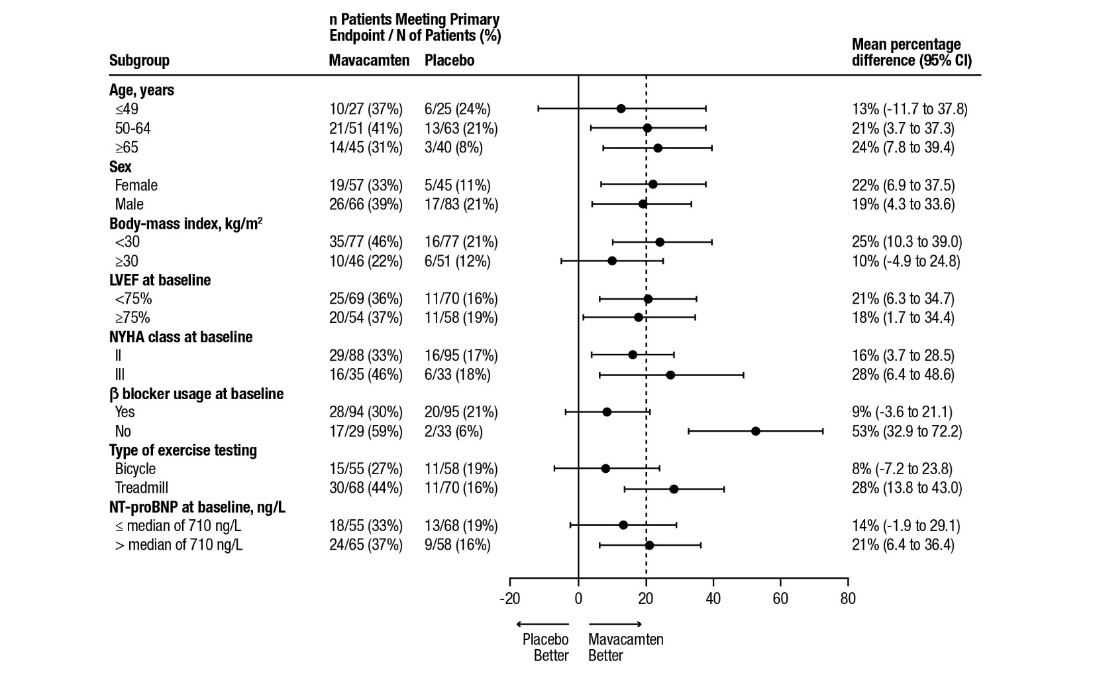
1차 분석 결과는 분석된 모든 하위 그룹에서 CAMZYOS를 일관되게 선호했습니다(그림 4).
그림 4: 1차 복합 기능적 종료점의 하위 그룹 분석
점선 수직선은 전반적인 치료 효과를 나타내고 실선 수직선(효과 없음)은 치료 그룹 간에 차이가 없음을 나타냅니다.
참고: 위 그림은 다양한 하위 그룹의 효과를 나타내며, 모두 기준 특성입니다.
표시된
95% 신뢰 한계는 수행된 비교 횟수를 고려하지 않으며 다른 모든 요인을 조정한 후 특정 요인의 효과를 반영하지 않을 수 있습니다.
그룹 간의 명백한 동질성 또는 이질성을 과도하게 해석해서는 안 됩니다.
배경 베타 차단제 치료를 받는 환자에서 마바캄텐의 이점은 치료를 받지 않는 환자보다 적었지만(pVO2의 개선 정도 감소 ) , 다른 2차 종료점(증상, LVOT 기울기)에 대한 분석 결과, 환자는 베타 차단제 사용 여부와 관계없이 마바캄텐 치료로 이점을 얻을 수 있는 것으로 나타났습니다.
2차 종료점
CAMZYOS가 LVOT 폐쇄, 기능적 용량 및 건강 상태에 미치는 치료 효과는 운동 후 LVOT 피크 기울기의 기준선에서 30주차까지의 변화, pVO2의 변화 , NYHA 분류에서 개선이 있는 환자의 비율, Kansas City Cardiomyopathy Questionnaire-23(KCCQ-23) 임상 요약 점수(CSS), 비대성 심근증 증상 설문지(HCMSQ) 호흡곤란(SoB) 도메인 점수를 통해 평가했습니다.
30주차에 CAMZYOS를 투여받은 환자는 모든 2차 종료점에서 위약군에 비해 더 큰 개선을 보였습니다(표 3, 그림 5, 그림 6, 표 4 및 그림 7-10).
|
캠시오스 숫자 = 123 |
위약 숫자 = 128 |
차이(95% CI) |
p-값 |
|
|
운동 후 LVOT 기울기(mmHg), 평균 (에스디) |
-47(40) |
-10(30) |
-35 (-43, -28) |
<0.0001 |
|
pVO2 (mL/ kg /min), 평균 (에스디) |
1.4 (3.1) |
-0.1 (3.0) |
1.4 (0.6, 2.1) |
<0.0006 |
|
NYHA의 숫자(%) 수업 개선 ≥1 |
80 (65%) |
40(31%) |
34% (22%, 45%) |
<0.0001 |
그림 5: LVOT 피크 기울기에서 기준선에서 30주차까지의 변화의 누적 분포
그림 6: pVO2의 기준선에서 30주차까지의 변화의 누적 분포
|
† KCCQ‑23 CSS는 KCCQ‑23의 Total Symptom Score(TSS)와 Physical Limitations(PL) 점수에서
파생되었습니다. |
|||||
|
기준선, 평균(SD) |
기준선에서 30주차까지의 변화, 평균 (에스디) |
차이점, LS 평균 (95%CI) 및 p-값 |
|||
|
캠시오스 |
위약 |
캠시오스 |
위약 |
||
|
KCCQ‑23 CSS † |
숫자=99 71 (16) |
숫자=97 71 (19) |
14(14) |
4(14) |
9(5, 13) 유의수준 <0.0001 |
|
KCCQ-23 TSS |
71 (17) |
69 (22) |
12(15) |
5 (16) |
|
|
KCCQ-23 PL |
70(18) |
72(19) |
15 (17) |
4(15) |
|
|
HCMSQ SoB ‡ |
숫자=108 5 (3) |
숫자=109 5 (3) |
-3(3) |
-1 (2) |
-2 (-2, -1) 유의수준 <0.0001 |
그림 7은 KCCQ-23 CSS의 변화에 대한 시간 경과를 보여줍니다.
그림 8은 KCCQ-23 CSS의 기준선에서 30주차까지의 변화 분포를 보여줍니다.
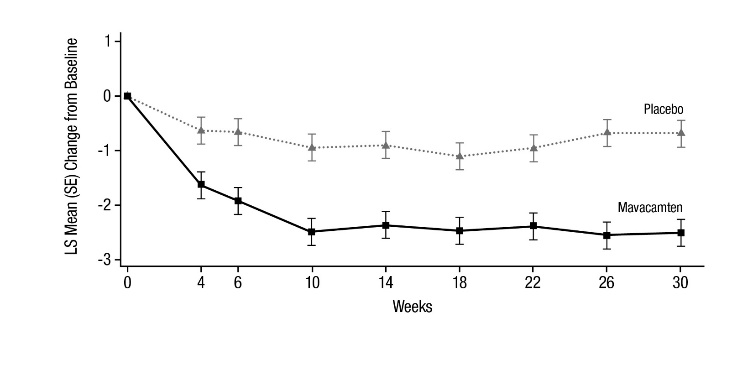
그림 7: KCCQ-23 임상 요약 점수: 시간 경과에 따른 기준선 대비 평균 변화
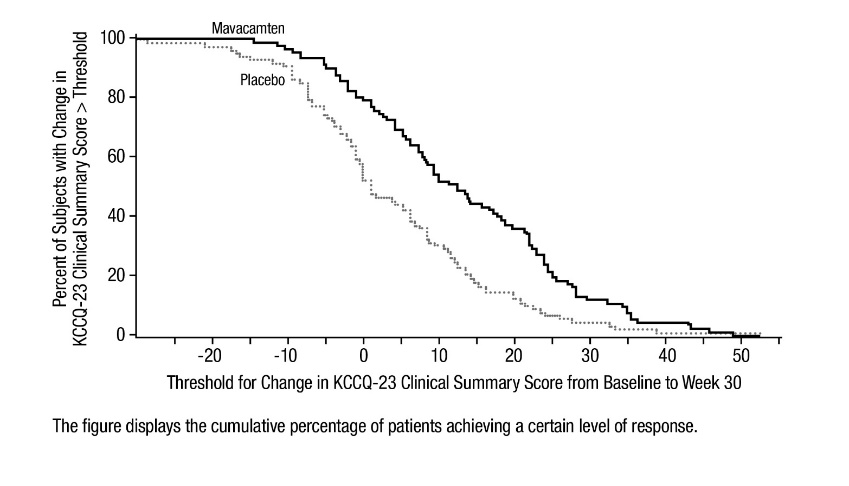
그림 8: KCCQ-23 임상 요약 점수: 기준선에서 30주차까지의 변화의 누적 분포
그림 9는 HCMSQ SoB의 변화에 대한 시간 경과를 보여줍니다.
그림 10은 HCMSQ SoB의 기준선에서 30주차까지의 변화 분포를 보여줍니다.
그림 9: HCMSQ 호흡곤란 도메인: 시간 경과에 따른 기준선 대비 평균 변화
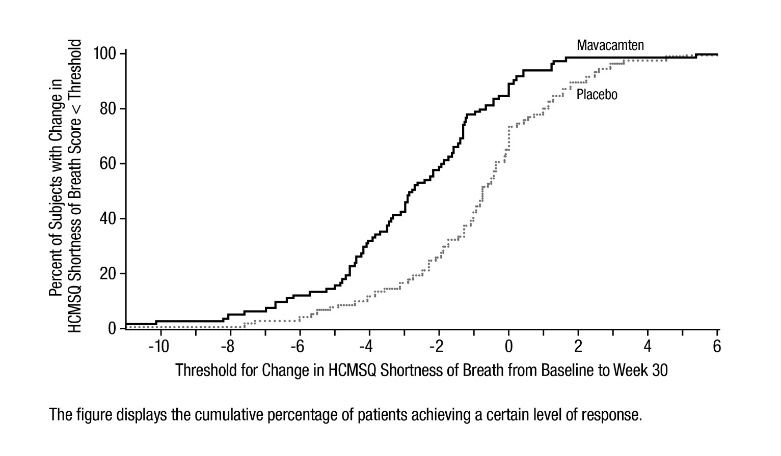
그림 10: HCMSQ 호흡곤란 도메인: 기준선에서 30주차까지의 변화 누적 분포
발로르-HCM
CAMZYOS의 효능은 112명의 환자(평균 연령 60세, 남성 51%, NYHA III 등급 93%)를 대상으로 CAMZYOS 또는 위약으로 치료를 받도록 1:1로 무작위 배정한 3상 이중 맹검 무작위 16주 위약 대조 시험인 VALOR-HCM에서 평가되었습니다.
기준선에서 모든 환자는 증상이 있는 폐쇄성 HCM이 있었고 SRT 적격자였습니다.
심각한 증상이 있는 약물 내성 폐쇄성 HCM(베타 차단제, 칼슘 채널 차단제 및/또는 디소피라미드의 조합을 사용하는 33% 포함; 디소피라미드 단독 또는 다른 치료와 병용하여 사용하는 20% 포함)과 운동성 실신 또는 실신에 가까운 NYHA 분류 III/IV 또는 분류 II를 가진 환자가 연구에 포함되었습니다.
환자는
휴식
시 또는 도발 시 LVOT 피크 기울기 ≥50 mmHg, LVEF ≥60%를 가져야 했습니다.
환자는 지난 12개월 이내에 SRT를 위해 의뢰되었거나 적극적으로 고려 중이어야 하며 시술 일정을 적극적으로 고려하고 있어야 합니다.
환자들은 CAMZYOS(2.5mg, 5mg, 10mg 또는 15mg) 또는 위약 캡슐을 16주 동안 매일 한 번씩 투여받았습니다.
용량 조절은 임상적 심초음파 매개변수를 기반으로 했습니다.
1차 종료점
CAMZYOS는 16주차에 SRT를 진행하기로 한 환자의 결정(16주차 이전 또는 16주차에 SRT 진행 결정의 합성) 또는 SRT 적격성(LVOT 기울기 ≥ 50 mmHg 및 NYHA 분류 III-IV 또는 운동성 실신 또는 실신에 가까운 경우 분류 II)을 충족한 환자의 비율을 감소시키는 데 있어 위약보다 우수한 것으로 나타났습니다(각각 18% 대 77%, p<0.0001, 표 5 참조).
|
*NYHA III 또는 IV 등급, 또는 운동 유발 실신 또는 실신에 가까운 등급, 휴식 시 또는 자극 시(예: 발살바 또는 운동) 동적 LVOT 경사도 ≥ 50 mmHg인 II 등급. |
||||
|
캠시오스 N (%) 숫자=56 |
위약 N (%) 숫자=56 |
치료의 차이 (95% 신뢰구간) |
p-값 |
|
|
1차 효능 복합 종료점 |
10 (18) |
43 (77) |
59% |
<0.0001 |
|
SRT를 진행하기로 한 환자 결정 |
2 (3.6) |
2 (3.6) |
||
|
가이드라인 기준에 따라 SRT 적격 |
8(14) |
39 (70) |
||
|
SRT 상태 평가 불가( |
0 |
2 (3.6) |
||
2차 종료점
CAMZYOS가 LVOT 폐쇄, 기능적 용량, 건강 상태에 미치는 치료 효과는 기준선에서 16주차까지 운동 후 LVOT 기울기의 변화, NYHA 분류에서 개선을 보인 환자의 비율, KCCQ-23 CSS를 통해 평가되었습니다.
|
† KCCQ-23 CSS는 KCCQ-23의 Total Symptom Score(TSS)와 Physical Limitations(PL) 점수에서
파생되었습니다. |
||||
|
캠시오스 숫자 = 56 |
위약 숫자 = 56 |
차이점 (95% 신뢰구간) |
p-값 |
|
|
운동 후 LVOT 기울기(mmHg), 평균(SD) |
-39 (37) |
-2 (29) |
-38 (-49, -28) |
<0.0001 |
|
NYHA Class가 ≥1 향상된 수(%) |
35 (63%) |
12 (21%) |
41% (25%, 58%) |
<0.0001 |
|
KCCQ-23 CSS † , 평균(SD) |
10 (16) |
2 (12) |
9 (5, 14) |
<0.0001 |
|
| ||||
10
(16)
2
(14)
10
(5, 15)
10
(19)
2
(17)
10
(5, 16)
그림 11은 KCCQ-23 CSS의 변화에 대한 시간 경과를 보여줍니다.
그림 12는 KCCQ-23 CSS에 대한 기준선에서 16주차까지의 변화 분포를 보여줍니다.
그림 11: KCCQ-23 임상 요약 점수: 시간 경과에 따른 기준선 대비 평균 변화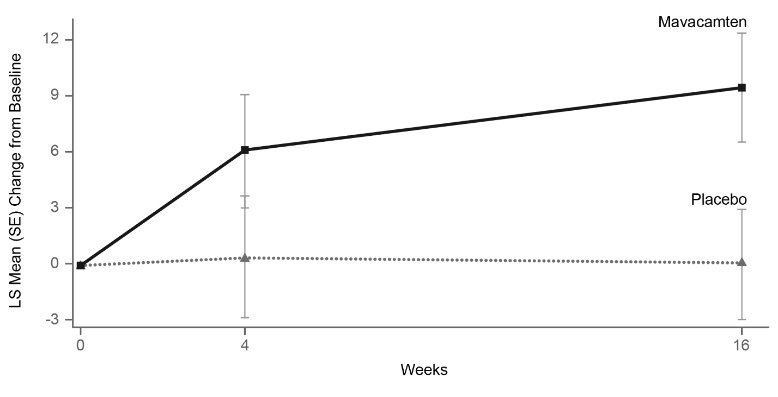
그림 12: KCCQ-23 임상 요약 점수: 기준선에서 16주차까지의 변화의 누적 분포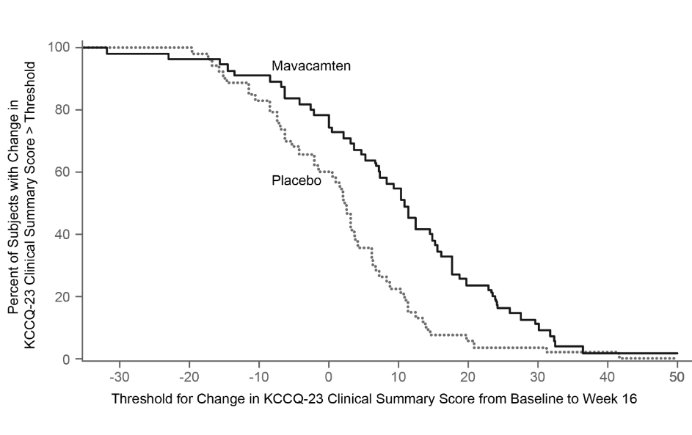
이 그림은 특정 수준의 반응을 달성한 환자의 누적 백분율을 보여줍니다.
16. Camzyos는 어떻게 공급되나요?
CAMZYOS ® 는 2.5mg, 5mg, 10mg 또는 15mg의 마바캄텐을 함유한 즉시 방출형 2호 경질 젤라틴 캡슐로 공급됩니다.
흰색 불투명 캡슐 본체에는 "Mava"가 각인되어 있으며, 불투명 캡에는 강도가 각인되어 있습니다.
캡슐에는 흰색에서 흰색에 가까운 분말이 들어 있습니다.
CAMZYOS 캡슐은 아래 표에 나열된 대로 30캡슐 병으로 제공됩니다.
|
힘 |
캡슐캡 |
NDC 번호 |
|
2.5mg |
연보라색 |
73625-111-11 |
|
5mg(5mg) |
노란색 |
73625-112-11 |
|
10mg |
분홍색 |
73625-113-11 |
|
15밀리그램 |
회색 |
73625-114-11 |
저장
20°C~25°C(68°F~77°F)에서 보관하고 15°C~30°C(59°F~86°F) 사이의 온도 변화가 허용됩니다 . [USP 관리실 온도 참조]
17. 환자 상담 정보
환자 및/또는 간병인에게 FDA 승인 환자 라벨(약물 가이드)을 읽으라고 조언하세요.
심부전
환자에게 심부전을 모니터링하기 위해 심장초음파를 사용하여 심장 기능 모니터링을 수행해야 한다는 사실을 알립니다 . [ 경고 및 주의사항(5.1) 참조 ] 환자에게 심부전의 징후나 증상이 있으면 즉시 의료 서비스 제공자에게 보고하도록 조언합니다.
약물 상호 작용
환자에게 CAMZYOS 치료 전과 치료 중에 오메프라졸, 에소메프라졸, 시메티딘 등의 일반 의약품과 보충제를 포함한 모든 병용 제품에 대해 의료 서비스 제공자에게 알리도록 조언합니다.
CAMZYOS REMS 프로그램
CAMZYOS는 CAMZYOS REMS 프로그램이라는 제한된 프로그램을 통해서만 사용할 수 있습니다 . [ 경고 및 주의사항(5.3) 참조 ] 환자에게 다음의 주목할 만한 요구 사항을 알리십시오.
CAMZYOS는 인증된 의료 서비스 제공자에 의해서만 처방되고 프로그램에 참여하는 인증된 약국에서만 분배됩니다.
환자에게 제품 구입 방법에 대한 정보를 제공하는 전화번호와 웹사이트를 제공하십시오 [ 경고 및 주의사항(5.3) 참조 ] .
배아-태아 독성
임신 여성 및 생식 잠재력이 있는 여성에게 태아에 대한 잠재적 위험에 대해 알리십시오. 생식 잠재력이 있는 여성에게 알려진 또는 의심되는 임신을 의료 제공자에게 알리도록 알리십시오 [ 경고 및 주의사항(5.4) 및 특정 집단에서의 사용(8.1 , 8.3) 참조 ] .
생식 잠재력이 있는 여성에게 CAMZYOS 치료 중 및 마지막 복용 후 4개월 동안 효과적인 피임법을 사용하도록 조언하십시오.
에티닐에스트라디올과 노르에틴드론의 조합을 함유한 CHC는 마바캄텐과 함께 사용할 수 있습니다.
그러나 CAMZYOS는 특정 다른 복합 호르몬 피임약(CHC)의 효과를 감소시킬 수 있습니다.
이러한 CHC를 사용하는 경우 환자에게 CAMZYOS의 동시
사용 중
및 마지막 복용 후 4개월 동안 비호르몬 피임약(예: 콘돔)을 추가하도록 조언하십시오 [ 약물 상호 작용(7.2) 및 특정 집단에서의 사용(8.3) 참조 ] .
임신 중에 CAMZYOS에 노출된 여성에게 임신 결과를 모니터링하는 임신 안전 연구가 있다고 알리십시오. 이러한 환자에게 1-800-721-5072 또는 www.bms.com으로 Bristol-Myers Squibb에 임신 사실을 보고하도록 권장하십시오.
CAMZYOS 복용 지침
CAMZYOS 캡슐은 통째로 삼켜야 합니다.
환자에게 CAMZYOS 복용을 놓친 경우 그날 가능한 한 빨리 복용하고 다음 예정된 복용량은 다음 날 평소 시간에 복용하도록 조언하십시오. 환자는 같은 날에 두 번 복용해서는 안 됩니다.
마케팅:
Bristol-Myers Squibb Company
Princeton, NJ 08543 USA
CAMZYOS ® 는 Bristol Myers Squibb 계열사인 MyoKardia, Inc.의 상표입니다.
약물 가이드
심부전은 사망으로 이어질 수 있는 심각한 상태입니다.
의료 제공자가 CAMZYOS에 심장이 어떻게 반응하는지 이해하도록 돕기 위해 첫 번째 복용량을 복용하기 전과 CAMZYOS 치료 중에 심초음파 검사를 받아야 합니다.
심각한 감염이나 불규칙한 심장 박동이 발생하는 사람은 CAMZYOS 치료 중에 심부전 위험이 더 큽니다.
o 호흡곤란
o 다리가 부어오름
o 가슴 통증
o 심장이 두근거리는 느낌(두근거림)
피로
o 급격한 체중 증가
CAMZYOS 치료 전과 치료 중에 처방약과 일반 의약품을 포함하여 복용하는 약물에 대해 의료 서비스 제공자에게 알리십시오.
CAMZYOS REMS 프로그램에 등록하는 방법에 대해 의료 서비스 제공자와 상의하세요. 등록 시 프로그램에 대한 정보를 받게 됩니다.
여기에는 의료 서비스 제공자의 지시에 따라 심초음파검사를 받으러 다시 방문하는 것이 포함됩니다.
귀하의 의료 서비스 제공자는 인증 약국을 찾는 방법에 대한 정보를 제공할 수 있습니다.
지역 약국에서는 CAMZYOS를 구입할 수 없습니다.
부작용에 대한 정보는 "CAMZYOS의 가능한 부작용은 무엇입니까?"를 참조하세요 .
CAMZYOS란 무엇인가요?
CAMZYOS는 증상이 있는 폐쇄성 비대성 심근병(HCM)이 있는 성인을 치료하는 데 사용되는 처방약입니다.
CAMZYOS는 증상과 활동 능력을 개선할 수 있습니다.
CAMZYOS가 어린이에게 안전하고 효과적인지는 알려져 있지 않습니다.
CAMZYOS를 복용하기 전에 의료 서비스 제공자에게 다음을 포함한 모든 건강 상태에 대해 알리십시오.
CAMZYOS는 태아에게 해를 끼칠 수 있습니다.
CAMZYOS 치료 중에 임신하거나 임신했을 수 있다고 생각되면 즉시 의료 제공자에게 알리십시오. 또한 Bristol-Myers Squibb에 1-800-721-5072로 전화하거나 www.bms.com으로 전화하여 임신 사실을 보고할 수도 있습니다.
CAMZYOS 치료 중 효과적인 피임 형태 사용에 대해 의료 서비스 제공자와 상의하세요.
CAMZYOS가 모유로 전달되는지는 알려져 있지 않습니다.
CAMZYOS 치료 중에 아기에게 먹이를 주는 가장 좋은 방법에 대해 의료 제공자와 상의하세요.
CAMZYOS 치료 전과 치료 중에 처방약과 일반 의약품, 비타민, 한방 보충제를 포함하여 복용하는 모든 약물에 대해 의료 서비스 제공자에게 알리십시오 . CAMZYOS를 특정 약물이나 자몽 주스와 함께 복용하면 심부전이 발생할 수 있습니다.
의료 서비스 제공자에게 알리지 않고 약물 복용을 중단하거나 복용량을 변경하거나 새로운 약물을 시작하지 마십시오.
특히 다음과 같은 경우 의료 서비스 제공자에게 알리십시오.
CAMZYOS를 어떻게 복용해야 하나요?
CAMZYOS의 가능한 부작용은 무엇입니까?
CAMZYOS는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
CAMZYOS의 가장 흔한 부작용은 다음과 같습니다: 현기증과 실신(실신).
CAMZYOS의 가능한 부작용은 여기에 전부가 아닙니다.
부작용에 대한 의학적 조언을 받으려면 의사에게 전화하세요. 부작용은 FDA에 1-800-FDA-1088로 보고할 수 있습니다.
또한 1-800-721-5072로 브리스톨-마이어스 스퀴브에 부작용을 보고할 수 있습니다.
CAMZYOS는 어떻게 보관해야 하나요?
CAMZYOS는 68°F~77°F(20°C~25°C)의 실온에서 보관하세요.
CAMZYOS와 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하세요.
CAMZYOS의 안전하고 효과적인 사용에 대한 일반 정보.
약물은 때때로 약물 가이드에 나열된 목적 외의 목적으로 처방됩니다.
CAMZYOS를 처방되지 않은 질환에 사용하지 마십시오. 다른 사람에게 CAMZYOS를 주지 마십시오. 다른 사람이 당신과 같은 증상을 가지고 있더라도 말입니다.
해로울 수 있습니다.
의료 전문가를
위해 작성된
CAMZYOS에 대한 정보는 의료 서비스 제공자나 약사에게 문의할 수 있습니다.
CAMZYOS의 성분은 무엇입니까?
활성 성분: 마바캄텐
비활성 성분: 크로스카멜로스 나트륨, 히프로멜로스, 스테아르산 마그네슘(소 제외), 만니톨, 이산화규소. 캡슐에는 검은 산화철, 젤라틴, 붉은 산화철, 이산화티타늄, 노란 산화철이 들어 있습니다.
마케팅 제공자:
브리스톨-마이어스 스퀴브 회사
프린스턴, 뉴저지 08543 미국
CAMZYOS ® 는 Bristol Myers Squibb 계열사인 MyoKardia, Inc.의 상표입니다.
자세한 내용은 www.CAMZYOS.com을 방문하시거나 1-800-721-5072로 전화해주세요.
이 약물 안내서는 미국 식품의약국에서 승인을 받았습니다.
개정: 04/2024
CAMZYOS 2.5 mg 라벨
CAMZYOS는 HCM을 근원에서 표적으로 삼는 최초이자 유일하게 승인된 심장 미오신 억제제입니다 .
CAMZYOS는 심장 미오신에 대한 선택적 이성질성 및 가역적 억제제로, 오프 상태에서 미오신 헤드의 수를 조절하는 데 도움이 됩니다.
이는
형성되는 미오신-액틴 교차 다리의 수를 줄입니다.
1
HCM=비대성 심근병; LVOT=좌심실 유출로; NYHA=뉴욕 심장 협회.
CAMZYOS가 어떻게 작동하는지 확인하세요
![]()
CAMZYOS에 대한 추가 세부 정보 보기
패키지 인서트 / 제품 라벨
일반 이름: 마바캄텐
투여 형태: 캡슐, 젤라틴 코팅
약물 분류: 기타 심혈관제
Drugs.com에서 의학적으로 검토 . 마지막 업데이트 2024년 5월 16일.
이 페이지에서
- 적응증 및 사용법
- 용량 및 투여
- 복용 형태 및 강도
- 금기사항
- 경고 및 예방 조치
- 부작용/부작용
- 약물 상호 작용
- 특정 인구에서의 사용
- 과다복용
- 설명
- 임상약리학
- 비임상 독성학
- 임상 연구
- 공급/보관 및 취급 방법
- 환자 상담 정보
- 약물 가이드
처방 정보의 하이라이트
이러한 하이라이트에는 CAMZYOS를 안전하고 효과적으로 사용하는 데 필요한 모든 정보가 포함되어 있지 않습니다.
CAMZYOS에 대한 전체 처방 정보를 참조하세요. 경구용
CAMZYOS ®
(mavacamten) 캡슐 최초 미국 승인: 2022
경고: 심부전 위험
전체 박스형 경고에 대한 전체 처방 정보를 참조하세요.
( 5.1 )
( 2.1 , 5.1 )
( 4 , 5.2 , 7 )
( 5.3 )
최근 주요 변경 사항
|
경고 및 예방 조치, 심부전( 5.1 ) |
06/2023 |
|
경고 및 예방 조치, 배아-태아 독성( 5.4 ) |
04/2024 |
Camzyos의 적응증 및 사용법
CAMZYOS는 성인의 증상성 뉴욕 심장 협회(NYHA) II-III급 폐쇄성 비대성 심근병(HCM) 치료에 적응된 심장 미오신 억제제로 기능적 능력과 증상을 개선합니다.
( 1 )
Camzyos 복용량 및 투여
복용량은 임상 상태와 환자 반응에 대한 심초음파 평가에 따라 개별화해야 합니다.
지침은 전체 처방 정보( 2.1 ) 를 참조하십시오.
복용 형태 및 강도
캡슐 : 2.5mg, 5mg, 10mg, 15mg( 3 )
금기사항
경고 및 예방 조치
생식 가능성이 있는 여성에게 마지막 복용 후 4개월까지 효과적인 피임법을 사용하도록 조언하십시오. 노르에틴드론이 아닌 프로게스틴을 함유한 복합 호르몬 피임약과 병용 사용을 피하십시오. ( 5.4 , 7.2 , 8.1 , 8.3 )
부작용/부작용
CAMZYOS를 투여받은 환자의 5% 이상에서 발생했으며 위약 투여군보다 더 흔하게 나타난 이상 반응은 현기증(27%)과 실신(6%)이었습니다.
( 6.1 )
의심되는 부작용을 보고하려면 1-800-721-5072로 Bristol-Myers Squibb에 연락하거나 1-800-FDA-1088 또는 www.fda.gov/medwatch로 FDA에 연락하세요.
약물 상호 작용
억제제를 시작하는 경우 CAMZYOS 용량 감소 및 추가 모니터링이 필요합니다.
( 2.2 , 7.1 )
특정 음성 이노트로프 조합은 피하십시오. ( 7.2 )
환자 상담 정보 및 약물 가이드는 17을 참조하십시오.
개정: 4/2024
전체 처방 정보
경고: 심부전 위험
CAMZYOS는 좌심실 박출률(LVEF)을 감소시키고 수축 기능 장애로 인한 심부전을 유발할 수 있습니다 . [ 경고 및 주의사항(5.1) 참조 ]
CAMZYOS 치료 전과 치료 중에 LVEF의 심초음파 평가가 필요합니다.
LVEF가 55% 미만인 환자에게 CAMZYOS를 시작하는 것은 권장되지 않습니다.
방문 시 LVEF가 50% 미만이거나 환자가 심부전 증상이나 임상 상태 악화를 경험하는
경우 CAMZYOS를 중단합니다.
[ 투여량 및 투여(2.1) 및 경고 및 주의사항(5.1) 참조 ] .
특정 시토크롬 P450 억제제와 CAMZYOS를 동시에 사용하거나 특정 시토크롬 P450 유도제를 중단하면 수축 기능 장애로 인한 심부전 위험이 증가할 수 있으므로 다음과 같은 경우에는 CAMZYOS를 사용하는 것이 금기입니다.
[ 금기증(4) 및 경고 및 주의사항(5.2) 참조 ] :
수축 기능 장애로 인한 심부전 위험 때문에 CAMZYOS는 CAMZYOS REMS PROGRAM이라는 위험 평가 및 완화 전략(REMS)에 따른 제한된 프로그램을 통해서만 제공됩니다 . [ 경고 및 주의사항(5.3) 참조]
1. Camzyos의 적응증 및 사용법
CAMZYOS ® 는
증상이 있는 뉴욕 심장협회(NYHA) 2-3급 폐쇄성 비대성 심근병(HCM)을 앓고 있는 성인 환자의 기능적 능력과 증상을 개선하는 데 사용됩니다.
2. Camzyos 복용량 및 투여
2.1 치료의 시작, 유지 및 중단
생식 잠재력이 있는 여성에게 임신이 이루어지지 않았는지와 효과적인 피임법을 사용했는지 확인하십시오 . [ 경고 및 주의사항(5.4) 참조 ]
LVEF <55%인 환자에게 CAMZYOS의 투여를 시작하거나 적정량을 증가시키는 것은 권장되지 않습니다.
권장 시작 용량은 음식과 관계없이 1일 1회 경구 5mg입니다.
적정을 통한 허용 가능한 후속 용량은 1일 1회 경구 2.5mg, 5mg, 10mg 또는 15mg입니다.
최대 권장 용량은 1일 1회 경구 15mg입니다.
환자는 CAMZYOS를 복용하는 동안 심부전을 일으킬 수 있습니다.
적절한 목표 Valsalva LVOT 기울기를 달성하고 LVEF ≥50%를 유지하며 심부전 증상을 피하기 위해 주의 깊게 적정하려면 정기적인 LVEF 및 Valsalva 좌심실 유출로(LVOT) 기울기 평가가 필요합니다(그림 1 및 그림 2 참조).
매일 복용하면 안정 상태의 약물 수치와 치료 효과에 도달하는 데 몇 주가 걸리며, 대사와 약물 상호작용의 유전적 변이로 인해 노출에 큰 차이가 생길 수 있습니다.
[ 박스형 경고 , 금기사항(4) , 경고 및 주의사항(5.2) , 약물 상호작용(7.1) 및 임상 약리학(12.3) 참조 ] .
CAMZYOS를 시작하거나 적정할 때는 먼저 LVEF를 고려한 다음 Valsalva LVOT 기울기와 환자의 임상 상태를 고려하여 적절한 CAMZYOS 투여량을 안내합니다.
적절한 CAMZYOS 투여 및 모니터링 일정을 위해 시작(그림 1) 및 유지(그림 2) 알고리즘을 따릅니다.
CAMZYOS 복용 중 LVEF <50%인 경우 치료를 중단합니다.
CAMZYOS 중단, 재시작 또는 중단에 대한 지침은 중단 알고리즘(그림 3)을 따릅니다.
2.5mg에서 중단된 경우 2.5mg에서 재시작하거나 영구적으로 중단합니다.
그림 1: 시작 단계
그림 2: 유지 관리 단계
그림 3: LVEF <50%인 경우 모든 진료소 방문 시 치료 중단
동시 질환(예: 심각한 감염)이나 수축 기능을 손상시킬 수 있는 부정맥(예: 심방세동 또는 기타 조절되지 않는 빈맥성 부정맥)이 있는 경우 지연 투여량을 증가시킵니다.
동시 질환이 있는 환자에게는 CAMZYOS 중단을 고려하십시오. [ 경고 및 주의사항(5.1) 참조 ]
복용을 놓치거나 지연한 경우
복용을 놓친 경우 가능한 한 빨리 복용해야 하며, 다음 예정된 복용량은 다음 날 평소 시간에 복용해야 합니다.
하루 중 정확한 복용 시간은 필수가 아니지만, 같은 날에 두 번 복용해서는 안 됩니다.
캡슐을 통째로 삼키십시오. 캡슐을 깨거나, 열거나, 씹지 마십시오.
2.2 약한 CYP2C19 또는 중간 CYP3A4 억제제의 동시 투여
약한 CYP2C19 억제제 또는 중등도 CYP3A4 억제제로 안정적으로 치료를 받고 있는 환자에게는 권장 초기 용량인 1일 1회 경구 5mg으로 CAMZYOS를 투여를 시작합니다.
약한 CYP2C19 억제제 또는 중등도 CYP3A4 억제제를 시작하는 환자의 경우 CAMZYOS의 용량을 한 단계 줄입니다(예: 15mg → 10mg; 10mg → 5mg; 또는 5mg → 2.5mg). 억제제 시작 후 4주 후에 임상 및 심초음파 평가를 예약하고 억제제 시작 후 12주가 지나기 전까지 CAMZYOS를 상향 조정하지 마십시오. 2.5mg의 CAMZYOS로 안정적으로 치료를 받고 있는 환자의 경우 약한 CYP2C19 억제제와 중등도 CYP3A4 억제제를 동시에 시작하는 것은 피하십시오. 더 낮은 CAMZYOS 1일 1회 용량이 없기 때문입니다 [ 용량 및 투여(2.1) , 약물 상호 작용(7.1) 참조 ] .
5. 경고 및 예방 조치
5.1 심부전
CAMZYOS는 수축기 수축을 감소시키고 심부전을 일으키거나 심실 기능을 완전히 차단할 수 있습니다.
심각한 병발 질환(예: 심각한 감염)이나 부정맥(예: 심방세동 또는 기타 통제되지 않는 빈맥성 부정맥)을 경험하는 환자는 수축기 기능 장애 및 심부전을 일으킬 위험이 더 큽니다 [ 임상 시험 경험(6.1) 참조 ] .
치료 전과 치료 중에 환자의 임상 상태와 LVEF를 정기적으로 평가하고 그에 따라 CAMZYOS 용량을 조절하십시오 [ 용량 및 투여(2.1) 참조 ] . 새로운 또는 악화되는 부정맥, 호흡곤란, 흉통, 피로, 심계항진, 다리 부종 또는 N-말단 프로-B형 나트륨이뇨펩타이드(NT-proBNP) 상승은 심부전의 징후
및 증상일 수 있으며 심장 기능 평가도 실시해야 합니다.
무증상 LVEF 감소, 동반 질환 및 부정맥은 추가적인 투여량 고려가 필요합니다 . [ 투여량 및 투여법(2.1 , 2.2 ) 참조 ]
LVEF <55%인 환자에서 CAMZYOS의 시작은 권장되지 않습니다.
베타 차단제와 함께 디소피라미드, 라놀라진, 베라파밀 또는 베타 차단제와 함께 딜티아젬을 복용하는 환자에서 CAMZYOS의 동시 사용을 피하십시오.
이러한 약물과 조합은 좌심실 수축 기능 장애 및 심부전 증상의 위험을 증가시키고 임상 경험이 제한적입니다 . [ 약물 상호 작용(7) 참조 ].
5.2 CYP450 약물 상호작용으로 인한 심부전 또는 효과 상실
CAMZYOS는 주로 CYP2C19 및 CYP3A4 효소에 의해 대사됩니다.
CAMZYOS와 이러한 효소와 상호 작용하는 약물을 동시에 사용하면 심부전이나 효과 상실과 같은 생명을 위협하는 약물 상호 작용이 발생할 수 있습니다 [ 금기증(4) , 경고 및 주의사항(5.1) , 약물 상호 작용(7.1) 참조 ] .
환자에게 오메프라졸, 에소메프라졸 또는 시메티딘과 같은 일반 의약품을 포함하여 약물 상호작용의 가능성에 대해 알리십시오. 환자에게 CAMZYOS 치료 전과 치료 중에 모든 병용 제품에 대해 의료 서비스 제공자에게 알리도록 알리십시오 [ 약물 상호작용(7.1) , 환자 상담 정보(17) 참조 ] .
자세한 내용은 www.CAMZYOSREMS.com에서 확인하거나 1-833-628-7367로 전화해 문의하세요.
5.4 배아-태아 독성
동물 연구 결과에 따르면, CAMZYOS는 임신한 여성에게 투여 시 태아 독성을 일으킬 수 있습니다.
치료 전에 생식 가능성이 있는 여성의 임신이 없음을 확인하고 환자에게 CAMZYOS 치료 중과 마지막 복용 후 4개월 동안 효과적인 피임법을 사용하도록 조언하십시오. 에티닐에스트라디올과 노르에틴드론의 조합을 함
한
CHC는 마바캄텐과 함께 사용할 수 있습니다.
그러나 CAMZYOS는 특정 다른 복합 호르몬 피임법(CHC)의 효과를 감소시킬 수 있습니다.
이러한 CHC를 사용하는 경우 환자에게 CAMZYOS와 병용 사용하는 동안과 마지막 복용 후 4개월 동안 비호르몬 피임법(예: 콘돔)을 추가하도록 조언하십시오 [ 약물 상호 작용(7.2) 및 특정 집단에서의 사용(8.1 , 8.3 ) 참조] .
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되기 때문에 약물의 임상 시험에서 관찰된 부작용 발생률을 다른 약물의 임상 시험 발생률과 직접 비교할 수 없으며, 실제 임상에서 관찰된 발생률을 반영하지 않을 수도 있습니다.
CAMZYOS의 안전성은 3상 이중맹검 무작위 위약대조 시험인 EXPLORER-HCM에서 평가되었습니다 [ 임상 연구 참조(14) ] . 폐쇄성 HCM이 있는 251명의 성인 중 123명의 환자가 CAMZYOS 2.5-15mg을 매일 투여받았고 128명은 위약을 투여받았습니다.
CAMZYOS로 치료받은 환자의 중간 노출 기간은 30주였습니다(범위:
2-40주).
실신(0.8%)은 CAMZYOS를 투여받는 환자에서 투여 중단으로 이어진 유일한 이상반응이었습니다.
CAMZYOS를 투여받은 환자의 5% 이상에서 발생했으며 위약 투여군보다 흔하게 나타난 이상 반응은 현기증(27% 대 18%)과 실신(6% 대 2%)이었습니다.
CAMZYOS의 환자 안전성은 3상 이중맹검 무작위 위약대조 시험인 VALOR-HCM에서 추가로 평가되었습니다 [ 임상 연구 참조(14) ] . 증상이 있는 폐쇄성 HCM이 있는 성인 112명 중 56명의 환자가 CAMZYOS 2.5-15mg을 매일 투여받았고 55명은 위약을 투여받았습니다.
CAMZYOS로 치료받은 환자의
중간 노출 기간은 17주였습니다(범위: 3-19주).
VALOR-HCM에서는 새로운 부작용이 확인되지 않았습니다.
수축 기능에 대한 효과
EXPLORER-HCM 시험에서 평균(SD) 휴식 LVEF는 두 치료군 모두 기준선에서 74%(6)였습니다.
CAMZYOS의 작용 기전과 일관되게, 30주 치료 기간 동안 LVEF의 기준선에서의 평균(SD) 절대 변화량은 CAMZYOS 군에서 -4%(8)이고 위약군에서 0%(7)였습니다.
8주간 시험
약물을
중단한 후 38주차에 두 치료군의 평균 LVEF는 기준선과 유사했습니다.
EXPLORER-HCM 시험에서 CAMZYOS 군에서 7명(6%), 위약군에서 2명(2%)이 치료 중에 LVEF가 <50%(중앙값 48%: 범위 35-49%)로 가역적으로 감소했습니다.
7명의 CAMZYOS 환자 중 3명과 2명의 위약 환자 중 1명에서 이러한 감소는 무증상이었습니다.
CAMZYOS로 치료받은 7명의 환자 모두에서 CAMZYOS 중단 후 LVEF가 회복되었습니다 . [ 경고 및 주의사항(5.1) 참조 ]
7. 약물 상호 작용
7.1 CAMZYOS의 혈장 농도에 영향을 미치는 다른 약물의 가능성
마바캄텐은 주로 CYP2C19에 의해 대사되고, CYP3A4와 CYP2C9에 의해 대사되는 정도는 낮습니다.
CYP2C19의 유도제 및 억제제와 CYP3A4의 중간에서 강한 억제제 또는 유도제는 마바캄텐의 노출에 영향을 미칠 수 있습니다 [ 경고 및 주의사항(5.2) 및 임상 약리학(12.3) 참조 ] . (표 1 참조 )
표 1: CAMZYOS와의 확립된 및 잠재적으로 중요한 약동학적 약물 상호 작용
CAMZYOS에 대한 다른 약물의 영향
|
중간~강력한 CYP2C19 억제제 또는 강력한 CYP3A4 억제제 |
|
|
임상적 영향 |
중간 내지 강력한 CYP2C19 억제제 또는 강력한 CYP3A4 억제제와 동시에 사용하면 마바캄텐 노출이 증가하여 수축 기능 장애로 인한 심부전 위험이 증가할 수 있습니다. |
|
예방 또는 관리 |
중간 정도에서 강력한 CYP2C19 억제제 또는 강력한 CYP3A4 억제제와 동시에 사용하는 것은 금기입니다. |
|
중간에서 강력한 CYP2C19 유도제 또는 중간에서 강력한 CYP3A4 유도제 |
|
|
임상적 영향 |
중간에서 강력한 CYP2C19 유도제 또는 중간에서 강력한 CYP3A4 유도제와 동시에 사용하면 마바캄텐 노출이 감소하여 CAMZYOS의 효능이 감소할 수 있습니다 [ 임상 약리학(12.3) 참조 ] . 유도 효소 수치가 정상화됨에 따라 이러한 유도제 중단으로 인해 수축 기능 장애로 인한 심부전 위험이 증가할 수 있습니다 [ 금기증(4) 및 경고 및 주의사항(5.2) 참조 ] . |
|
예방 또는 관리 |
중간에서 강력한 CYP2C19 유도제 또는 중간에서 강력한 CYP3A4 유도제를 동시에 사용하는 것은 금기입니다. |
|
약한 CYP2C19 억제제 또는 중간 CYP3A4 억제제 |
|
|
임상적 영향 |
약한 CYP2C19 억제제 또는 중간 정도의 CYP3A4 억제제와 동시에 사용하면 마바캄텐 노출이 증가하여 부작용의 위험이 높아질 수 있습니다. |
|
예방 또는 관리 |
약한 CYP2C19 억제제 또는 중등도 CYP3A4 억제제로 안정적으로 치료를 받고 있는 환자에게는 권장 초기 용량인 1일 1회 경구 5mg으로 CAMZYOS를 투여를 시작합니다. CAMZYOS 치료를 받고 있고 약한 CYP2C19 억제제나 중등도 CYP3A4 억제제를 시작할 계획인 환자의 경우 CAMZYOS의 용량을 한 단계(예: 15~10mg, 10~5mg 또는 5~2.5mg)만큼 감량합니다. |
7.2 CAMZYOS가 다른 약물의 혈장 농도에 영향을 미칠 가능성
특정 CYP3A4, CYP2C9 및 CYP2C19 기질
마바캄텐은 CYP3A4, CYP2C9 및 CYP2C19의 유도제입니다.
CYP3A4, CYP2C9 또는 CYP2C19 기질과 병용하면 이러한 약물의 혈장 농도가 감소할 수 있습니다 [ 임상 약리학(12.3) 참조 ]. 처방 정보에서 달리 권장하지 않는 한, CAMZYOS를 CYP3A4, CYP2C9 또는 CYP2C19 기질과 병용하는 경우 주의 깊게 모니터링하십시오.
특정 복합 호르몬 피임약(CHC)
프로게스틴과 에티닐에스트라디올은 CYP3A4 기질입니다.
CAMZYOS를 동시에 사용하면 특정 프로게스틴 노출이 감소할 수 있습니다 [ 임상
약리학(12.3) 참조 ] . 이는
피임 실패로 이어질 수 있습니다.
에티닐에스트라디올과 노르에틴드론의 조합을 함유한 CHC는 마바캄텐과 함께 사용할 수 있지만 다른 CHC를 사용하는 경우 환자에게 CAMZYOS를 동시에 사용하는 동안과 마지막 복용 후 4개월 동안 비호르몬 피임법(예: 콘돔)을 추가하도록 조언하십시오.
7.3 심장 수축력을 감소시키는 약물
CAMZYOS 및 심장 수축력을 감소시키는 다른 약물의 부가적 부정적 이노트로픽 효과를 예상하십시오. 베타 차단제와 함께 디소피라미드, 라놀라진, 베라파밀 또는 베타 차단제와 함께 딜티아젬을 복용하는 환자에게 CAMZYOS를 동시에 사용하는 것은 피하십시오. 이러한 약물과 조합은 좌심실 수축 기능 장애 및 심부전 증상의 위험을 증가시키고 임상 경험이 제한적입니다 . [ 경고 및 주의사항(5.1) 참조 ] .
음성 이노트로프와 병용 치료를 시작하거나 음성 이노트로프의 복용량을 늘린 경우, 안정적인 복용량과 임상적 반응이 나타날 때까지 LVEF를 면밀히 모니터링하세요.
8. 특정 인구에 사용
8.1 임신
위험 요약
동물 데이터에 따르면, CAMZYOS는 임산부에게 투여 시 태아에 해를 끼칠 수 있습니다.
주요 선천적 결함, 유산 또는 기타 모체 또는 태아에 대한 부작용의 약물 관련 위험을 평가하기 위해 임신 중에 CAMZYOS를 사용한 인간 데이터는 없습니다.
임신 중 기저 모체 상태는 모체와 태아에게 위험을 초래합니다 ( 임상 고려 사항 참조 ) . 임신 중 모체가 CAMZYOS에 노출되면 태아에 대한 잠재적 위험에 대해 임산부에게 알리십시오.
동물 배아-태아 발달 연구에서 쥐에서 마바캄텐 관련 태아 체중 감소, 태아 뼈 골화 감소, 이식 후 손실(조기 및/또는 후기 흡수) 증가가 관찰되었고, 최대 권장 인간 복용량(MRHD)에서 달성된 것과 유사한 복용량 노출에서 토끼와 쥐 모두에서 내장 및 골격 기형이 증가하는 것이 관찰되었습니다( 자료 참조 ) .
지정된 인구에 대한 주요 선천적 결함 및 유산의 추정 배경 위험은 알려져 있지 않습니다.
모든 임신에는 선천적 결함, 유산 또는 기타 불리한 결과의 배경 위험이 있습니다.
미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 결함 및 유산의 추정 배경 위험은 각각 2%~4% 및 15%~20%입니다.
CAMZYOS에 대한 임신 안전성 연구가 있습니다.
임신 중에 CAMZYOS를 투여하거나, 환자가 CAMZYOS를 투여하는 동안 또는 CAMZYOS의 마지막 복용 후 4개월 이내에 임신한 경우, 의료 서비스 제공자는 1-800-721-5072 또는 www.bms.com으로 Bristol-Myers Squibb에 연락하여 CAMZYOS 노출을 보고해야 합니다.
질병 관련 모성 및 배아-태아 위험
임신 중 폐쇄성 HCM은 조산 위험 증가와 관련이 있습니다.
동물 데이터
임신 쥐에게 장기 형성 기간 동안 마바캄텐을 경구 투여했을 때(0.3~1.5mg/kg/day), 고용량 그룹(1.5mg/kg/day)에서 착상 후 손실 증가, 태아 평균 체중 감소, 태아 뼈 골화 감소, 태아 기형(장기 및 골격)이 관찰되었습니다.
내장 기형(태아의 심장 기형, 완전한 좌골 역위 1건 포함)과 골격 기형(주로 융합된 흉골)의 발생률 증가가
MRHD에서 인간과 유사한 노출에서 관찰되었습니다.
쥐의 배아-태아 발달에 대한 무효과 용량에서 혈장 노출(농도-시간 곡선 아래의 면적 또는 AUC 기준)은 MRHD에서 인간의 노출의 0.3배입니다.
임신 토끼에게 기관 형성 기간 동안 마바캄텐을 경구 투여했을 때(0.6~2.0mg/kg/일), 태아 기형(장기 및 골격)이 1.2mg/kg/일 이상의 용량에서 증가했으며, 1.2mg/kg/일에서 MRHD에서 인간의 혈장 노출과 유사했습니다.
내장 소견은 대혈관 기형(폐동맥 줄기 및/또는 대동맥궁 확장)으로 구성되었습니다.
골격 기형은 ≥1.2mg/kg/일에서
융합된 흉골의 발생률이 더 높았습니다.
토끼의 배아-태아 발달에 대한 무효과 용량에서의 혈장 노출(AUC)은 MRHD에서 인간의 노출의 0.4배입니다.
출산 전/후 발달 연구에서, 마바캄텐은 임신 쥐에게 임신 6일부터 수유/산후 20일까지 경구 투여되었습니다(0.3~1.5mg/kg/일). 태어나기 전부터(자궁 내) 수유 기간까지 매일 노출된 어미 쥐나 새끼에게는 부작용이 관찰되지 않았습니다.
무관찰 부작용 수준(NOAEL)은 1.5mg/kg/일(테스트된 최고 용량 수준)이었고, MRHD에서 인간과
유사한 노출(AUC)을 보였습니다.
8.2 수유
위험 요약
인간 또는 동물의 모유에 마바캄텐이 존재하는지, 모유 수유하는 영아에게 미치는 약물의 영향, 모유 생산에 미치는 영향은 알려져 있지 않습니다.
모유 수유의 발달 및 건강상의 이점은 CAMZYOS에 대한 어머니의 임상적 필요성과 CAMZYOS 또는 기저 모체 상태에서 모유 수유하는 아이에게 미치는 잠재적인 부작용과 함께 고려해야
합니다.
8.3 생식 잠재력이 있는 여성과 남성
동물 데이터에 따르면 CAMZYOS는 임산부에게 투여 시 태아에게 해를 끼칠 수 있습니다.
[ 경고 및
주의사항(5.4) 및 특정 집단에서의 사용(8.1) 참조 ]
임신 테스트
CAMZYOS 투여를 시작하기 전에 생식 가능성이 있는 여성의 임신이 없음을 확인하십시오.
피임
안
생식 가능성이 있는 여성에게 CAMZYOS 치료 중 및 마지막 복용 후 4개월 동안 효과적인 피임법을 사용하도록 조언하십시오. 에티닐 에스트라디올과 노르에틴드론의 조합을 함유한 CHC는 마바캄텐과 함께 사용할 수 있습니다.
그러나 CAMZYOS는 특정 다른 복합 호르몬 피임법(CHC)의 효과를 감소시킬 수 있습니다.
이러한 CHC를
사용하는
경우 환자에게 CAMZYOS와 병용하는 동안 및 마지막 복용 후 4개월 동안 비호르몬 피임법(예: 콘돔)을 추가하도록 조언하십시오. [ 약물 상호 작용(7.2) 참조 ] .
8.5 노인 사용
임상 시험에는 CAMZYOS를 투여받은 319명의 환자가 포함되었으며, 그 중 119명은 65세 이상(37.3%)이었고, 25명(7.8%)은 75세 이상이었습니다.
안전성, 효과 및 약동학은 65세 이상 환자와 젊은 환자 간에 유사했습니다.
8.6 간 기능 장애
경증(Child-Pugh A)에서 중등도(Child-Pugh B) 간 장애 환자의 경우 용량 조절이 필요하지 않습니다.
경증(Child-Pugh A) 또는 중등도(Child-Pugh B) 간 장애 환자의 경우 마바캄텐 노출(AUC)이 정상 간 기능 환자에 비해 최대 220% 증가했습니다.
그러나 권장 용량 적정 알고리즘 및 모니터링 계획에 따라 경증에서
중등도
간 장애 환자의 경우 추가적인 용량 조절이 필요하지 않습니다.
중증(Child-Pugh C) 간 장애의 영향은 알려져 있지 않습니다 [ 임상 약리 참조(12.3) ] .
관리
11. Camzyos 설명
경구용 CAMZYOS 캡슐에는 심장 미오신 억제제인 마바캄텐이 함유되어 있습니다.
마바캄텐의 화학명은 3-(1-메틸에틸)-6-[[(1S)-1-페닐에틸]아미노]-2,4(1H , 3H ) - 피리 미딘 디온 입니다 . 분자식은 C15H19N3O2이고 , 분자량은 273.33g/mol입니다 .
마바캄텐의 구조식은 다음과 같다.
마바캄텐은 흰색에서 거의 흰색에 가까운 분말로, pH 2~10의 물과 수용액에 거의 녹지 않고, 메탄올과 에탄올에는 거의 녹지 않으며, DMSO와 NMP에는 잘 녹습니다.
CAMZYOS는 즉시 방출되는 2호 경질 젤라틴 캡슐로 제공되며, 활성 성분으로 캡슐당 2.5mg, 5mg, 10mg 또는 15mg의 마바캄텐과 다음의 비활성 성분을 함유합니다: 크로스카멜로스 나트륨, 히프로멜로스, 스테아르산 마그네슘(비소), 만니톨 및 이산화규소. 캡슐 껍질에는 검은색 식용 잉크, 검은색 산화철, 젤라틴, 적색 산화철, 이산화티타늄
및 황색 산화철이 포함되어 있습니다.
12. Camzyos - 임상 약리학
12.1 작용 기전
마바캄텐은 심장 미오신에 대한 선택적 이성질적이고 가역적인 억제제입니다.
마바캄텐은 "온 액틴"(전력 생성) 상태에 들어갈 수 있는 미오신 헤드의 수를 조절하여 힘을 생성하는(수축기) 및 잔류(이완기) 교차 다리 형성의 가능성을 줄입니다.
과도한 미오신 액틴 교차 다리 형성과 초이완 상태의
조절 장애는
HCM의 기계적 특징입니다.
마바캄텐은 전체 미오신 집단을 에너지 절약, 모집 가능한 초이완 상태로 전환합니다.
HCM 환자에서 마바캄텐으로 미오신을 억제하면 동적 LVOT 폐쇄가 감소하고 심장 충만 압력이 개선됩니다.
12.2 약력학
좌심실 박출률 및 좌심실 유출로 폐쇄
EXPLORER-HCM 시험에서 환자들은 4주차까지 평균 휴식 및 유발(Valsalva) LVOT 기울기가 감소했으며, 이는 30주 시험 내내 유지되었습니다.
30주차에 휴식 및 Valsalva LVOT 기울기의 기준선으로부터의 평균(SD) 변화는 CAMZYOS 그룹의 경우 각각 -39(29)mmHg 및 -49(34)mmHg였고 위약 그룹의 경우 각각 -6(28)mmHg 및 -12(31)mmHg였습니다.
Valsalva LVOT 기울기 감소는 일반적으로 정상 범위 내의 LVEF 감소를 동반했습니다.
CAMZYOS 중단 8주 후에 평균 LVEF 및 Valsalva LVOT 기울기는 기준선과 유사했습니다.
심장 구조
EXPLORER-HCM에서 심장 구조에 대한 심초음파 측정 결과, 마바캄텐군의 좌심실 질량 지수(LVMI)가 기준선에서 30주차에 평균(SD) 감소한 것으로 나타났습니다(-7.4[17.8] g/m 2 ). 반면 위약군의 LVMI는 증가했습니다(8.9[15.3] g/m 2 ). 또한 마바캄텐군의 좌심방
용적 지수(LAVI)도 기준선에서 평균(SD) 감소했습니다(-7.5[7.8] mL/m 2 ). 반면 위약군은 변화가 없었습니다(-0.1[8.7] mL/m 2 ). 이러한 결과의 임상적 유의성은 알려져 있지 않습니다.
심장 바이오마커
EXPLORER-HCM 시험 [ 임상 연구 참조(14) ] 에서 심장벽 스트레스의 바이오마커인 NT-proBNP의 감소가 4주차에 관찰되었으며 치료 종료 시까지 지속되었습니다.
기준선과 비교하여 30주차에 마바캄텐 치료 후 NT-proBNP 감소는 위약보다 80% 더 컸습니다(두 그룹 간 기하 평균 비율, 0.20
[95%
CI: 0.17, 0.24]).
VALOR-HCM 시험 [ 임상 연구 참조(14) ] 에서 NT-proBNP 감소는 8주차에 관찰되었고 치료 내내 지속되었습니다.
기준선과 비교하여 16주차에 마바캄텐 치료 후 NT-proBNP 감소는 위약보다 67% 더 컸습니다(두 그룹 간 기하 평균 비율의 비율, 0.33 [95% CI: 0.27, 0.42]). 기준선과 비교하여
16주차에 마바캄텐 치료 후 심장 트로포닌 I 감소는 위약보다 47% 더 컸습니다(두 그룹 간 기하 평균 비율의 비율, 0.53 [95% CI: 0.41, 0.70]).
NT-proBNP와 트로포닌 결과의 임상적 중요성은 알려져 있지 않습니다.
심장 전기 생리학
건강한 자원봉사자에게 CAMZYOS를 여러 번 투여한 결과, 1일 1회 최대 25mg의 용량에서 농도 의존적으로 QTc 간격이 증가하는 것으로 관찰되었습니다.
단일 용량 연구에서 유사한 노출에서 급성 QTc 변화는 관찰되지 않았습니다.
QT 연장 효과의 메커니즘은 알려져 있지 않습니다.
HCM 환자를 대상으로 한 임상 연구의 메타 분석은 치료 노출 범위에서 QTc 간격의 임상적으로 관련성 있는 증가를 시사하지 않습니다.
HCM에서 QT 간격은 기저 질환, 심실 조율과 관련하여 또는 HCM 집단에서 일반적으로 사용되는 QT 연장 가능성이 있는 약물과 관련하여 본질적으로 연장될 수 있습니다.
CAMZYOS를 다른 QT
연장 약물과
함께 투여하거나 칼륨 채널 변형으로 인해 QT 간격이 길어지는 환자의 경우의 효과는 특성화되지 않았습니다.
12.3 약동학
마바캄텐 노출은 1mg에서 15mg의 일일 1회 복용량을 여러 번 투여한 후 복용량에 비례하여 증가합니다.
CAMZYOS의 동일한 복용량 수준에서 건강한 대상자에 비해 HCM 환자는 마바캄텐 노출량이 170% 더 높습니다.
마바캄텐 축적은 CYP2C19 정상 대사자(NM)에서 Cmax의 경우 약 100%, AUC의 경우 약 600%입니다 . 축적은 CYP2C19 대사 상태에 따라 달라지며, 가장 큰 축적은 CYP2C19 대사 불량자(PM)에서 발생합니다.
정상 상태에서 일일 1회 복용 시 마바캄텐 혈장 농도의 피크 대 저점 비율은 약 1.5입니다.
흡수
마바캄텐의 경구 생체이용률은 최소 85%로 추산되며 최대 농도에 이르는 중간 시간(Tmax ) 은 1~2시간입니다.
음식의 효과
고지방 식사와 함께 마바캄텐을 투여한 경우 임상적으로 유의미한 AUC 차이는 관찰되지 않았습니다.
분포
마바캄텐의 혈장 단백질 결합률은 97~98%이다.
제거
마바캄텐은 CYP2C19 대사 상태에 따라 달라지는 가변적인 말단 t 1/2를 가지고 있습니다 . 마바캄텐 말단 반감기는 CYP2C19 정상 대사자(NM)에서 6~9일이고, CYP2C19 불량 대사자(PM)에서는 23일까지 연장됩니다.
대사
마바캄텐은 주로 CYP2C19(74%), CYP3A4(18%), CYP2C9(8%)를 통해 광범위하게 대사됩니다.
배설
방사성 표지된 마바캄텐 25mg을 단회 투여한 후, 투여량의 7%가 대변에서 회수되었고(1%는 변화 없음), 85%가 소변에서 회수되었습니다(3%는 변화 없음).
특정 인구
마바캄텐의 약동학에서 임상적으로 유의한 차이는 나이(범위: 18-82세), 성별, 인종, 민족 또는 경증(eGFR: 60~89 mL/min/1.73 m 2 )에서 중등도(eGFR: 30~59 mL/min/1.73 m 2 ) 신장 장애에 따라 관찰되지 않았습니다.
중증(eGFR: 15~30 mL/min/1.73
m 2 ) 신장 장애 및 신부전(eGFR: <15 mL/min/1.73 m 2 ; 투석 환자 포함)의 영향은 알려져 있지 않습니다.
간 기능 장애
마바캄텐 노출(AUC)은 경증(Child-Pugh A) 또는 중등도(Child-Pugh B) 간 손상 환자에서 최대 220% 증가했습니다.
중증(Child-Pugh C) 간 손상의 영향은 알려져 있지 않습니다.
약물 상호 작용
임상 연구 및 모델 기반 접근 방식
약한 CYP2C19 억제제: 마바캄텐(15mg)과 오메프라졸(20mg)을 하루 한 번 동시 투여한 결과, 건강한 CYP2C19 NM 환자와 빠른 대사자(RM, 예: *1/*17)에서 마바캄텐 AUC inf가 48% 증가했으며 Cmax 에는 영향이 없었습니다 .
중간 CYP3A4 억제제: 마바캄텐(25mg)과 베라파밀 지속 방출(240mg)을 병용 투여하면 중간 대사자(IMs; 예: *1/*2, *1/*3, *2/*17, *3/*17)와 CYP2C19의 NM에서 마바캄텐 AUC inf 가 16%, Cmax 가 52% 증가했습니다.
CYP2C19 PM에서 딜티아젬과 마바캄텐을 병용 투여하면 마바캄텐 AUC 0-24h 와 Cmax 가 각각 최대 55%와 42% 증가할 것으로 예상됩니다.
강력한 CYP3A4 억제제: 마바캄텐(15mg)과 케토코나졸 400mg을 하루 한 번 병용 투여할 경우 마바캄텐 AUC 0-24 와 Cmax 가 각각 최대 130%와 90%까지 증가할 것으로 예상됩니다.
강력한 CYP2C19 및 CYP3A4 유도제: 마바캄텐(단일 15mg 투여)과 강력한 CYP2C19 및 CYP3A4 유도제(리팜핀 600mg 일일 투여)를 병용 투여할 경우 CYP2C19 NM에서는 마바캄텐 AUC 0-inf 및 Cmax 가 각각 87% 및 22% 감소하고, CYP2C19 PM에서는 각각 69% 및 4% 감소하는 것으로 예측됩니다.
CYP3A4 기질: 16일 동안 마바캄텐(1일차와 2일차에 25mg, 그 후 14일 동안 15mg)을 병용 투여하면 건강한 대상자에서 미다졸람의 AUC inf 와 Cmax 가 각각 13%와 7% 감소했습니다.
치료 범위의 상한에 있는 HCM 환자에게 마바캄텐을 1일 1회 병용 투여한 후, 미다졸람의 AUC inf 와 Cmax 가 각각 최대 45%와 24% 감소할 것으로 예상됩니다.
특정 복합 경구 피임약: CYP2C19 NM 표현형을 가진 건강한 여성 피험자에서 에티닐 에스트라디올과 노르에틴드론이 함유된 복합 경구 피임약과 마바캄텐 17일 코스(1일차와 2일차에 25mg, 그 후 15일차에 15mg)를 동시에 사용한 후 에티닐 에스트라디올과 노르에틴드론
노출에 임상적으로 유의미한 차이가 관찰되지 않았습니다.
마바캄텐이 다른 프로게스틴이 함유된 경구 피임약에 미치는 영향은 알려져 있지 않습니다.
CYP2C8 기질: HCM 환자에게 마바캄텐을 하루에 한 번 병용 투여할 경우 CYP2C8과 CYP3A 기질인 레파글리나이드의 AUC와 Cmax 가 마바캄텐의 복용량과 CYP2C19 표현형에 따라 각각 최대 27%와 19%까지 감소할 것으로 예측됩니다.
CYP2C9 기질: HCM 환자에게 마바캄텐을 하루에 한 번 병용 투여할 경우 CYP2C9 기질인 톨부타미드의 AUC와 Cmax 가 마바캄텐의 복용량과 CYP2C19 표현형에 따라 각각 최대 54%와 23%까지 감소할 것으로 예측됩니다.
CYP2C19 기질: HCM 환자에게 마바캄텐을 하루에 한 번 병용 투여할 경우 CYP2C19 기질인 오메프라졸의 AUC와 Cmax 가 마바캄텐의 복용량과 CYP2C19 표현형에 따라 각각 최대 48%와 17%까지 감소할 것으로 예측됩니다.
활성탄: 마바캄텐 AUC 0-72h 및 AUC 0-무한대는 마바캄텐 15mg 단일 복용량 섭취 2시간 후에 소르비톨과 함께 활성탄 50g을 투여한 후 각각 14% 및 34% 감소했습니다.
마바캄텐 복용 6시간
후에
활성탄을 투여한 경우 마바캄텐 노출에 미치는 영향이 미미했습니다.
체외 연구
CYP 효소: 마바캄텐은 CYP1A2, CYP2B6, CYP2C8, CYP2D6, CYP2C9, CYP2C19 또는 CYP3A4를 억제하지 않습니다.
마바캄텐은 CYP2B6 유도제입니다.
수송체 시스템: 마바캄텐은 P-gp, BCRP, BSEP, MATE1, MATE2-K, 유기 음이온 수송 폴리펩티드(OATP), 유기 양이온 수송체(OCT), 또는 유기 음이온 수송체(OAT)를 억제하지 않습니다.
12.5 약리유전학
CYP2C19 불량 대사자(PM)에서 15mg의 마바캄텐을 단회 투여한 후 정상 대사자(NM)에 비해 마바캄텐 AUC inf가 241% 증가하고 Cmax 가 47% 증가했습니다.
CYP2C19 PM에서 NM에 비해 평균 반감기가 길어졌습니다(각각 23일 대 6~9일).
다형성 CYP2C19는 CAMZYOS 대사에 관여하는 주요 효소입니다.
두 개의 정상 기능 대립유전자를 가진 개인은 NM(예: *1/*1)입니다.
두 개의 비기능 대립유전자를 가진 개인은 PM(예: *2/*2, *2/*3, *3/*3)입니다.
CYP2C19 불량 대사자의 유병률은 조상에 따라 다릅니다.
유럽 조상의 약 2%와 아프리카 조상의 약 4%가 PM입니다.
PM의 유병률은 아시아 인구에서 더 높습니다(예: 동아시아인의 약 13%).
13. 비임상 독성학
13.1 발암, 돌연변이 및 생식 능력 손상
마바캄텐은 박테리아 역돌연변이 시험(에임스 시험), 인간 시험관 내 림프구 염색체 이상 시험 또는 쥐 생체 내 미소핵 시험에서 유전독성을 나타내지 않았습니다.
수컷의 경우 최대 2.0mg/kg/일, 암컷의 경우 최대 3.0mg/kg/일의 마바캄텐 복용량에서 6개월 rasH2 형질전환 마우스 연구나, 2년 랫드의 경우 최대 0.6mg/kg/일의 마바캄텐 복용량에서 발암성 증거는 발견되지 않았습니다.
마우스와 래트의 노출 기반(AUC) 안전 마진은 MRHD에서 인간의 AUC 노출과 비교했을 때 각각 최대 3배 또는
0.2배였습니다.
생식 독성 연구에서, 최대 1.2mg/kg/day의 용량에서 수컷 또는 암컷 쥐의 교미 및 생식력에 대한 마바캄텐의 효과나 최대 1.5mg/kg/day의 용량에서 암컷 새끼의 생존력 및 생식력에 대한 효과가 입증되지 않았습니다.
시험된 최고 용량에서 마바캄텐의 혈장 노출(AUC)은 MRHD에서 인간과 동일했습니다.
14. 임상 연구
익스플로러-HCM
CAMZYOS의 효능은 251명의 성인을 대상으로 한 3상 이중맹검 무작위 위약대조 다기관 국제 병행군 시험인 EXPLORER-HCM(NCT-03470545)에서 평가되었습니다.
이 시험은 NYHA II 및 III 등급의 증상이 있는 폐쇄성 HCM, LVEF ≥55%, 휴식 시 또는 자극 시 LVOT 최대 기울기 ≥50 mmHg를 앓고 있는 환자를 대상으로 실시되었습니다.
베타 차단제와 칼슘 채널 차단제 치료의 이중 요법 또는 디소피라미드나 라놀라진의 단일 요법을 받는 환자는 제외되었습니다.
파브리병, 아밀로이드증 또는 좌심실 비대가 있는 누난 증후군과 같이 폐쇄성 HCM을 모방하는 심장 비대를 유발하는 알려진 침윤성 또는 저장 장애가 있는 환자도 제외되었습니다.
환자들은 1:1 비율로 무작위로 배정되어 30주 동안 매일 한 번 CAMZYOS 5mg의 시작 용량 또는 위약을 투여받았습니다.
치료 배정은 기준 NYHA 기능 클래스, 기준 베타 차단제 사용, 에르고미터 유형(러닝머신 또는 운동용 자전거)에 따라 계층화되었습니다.
그룹은 나이(평균 59세), BMI(평균 30 kg/m 2 ), 심박수(평균 62 bpm), 혈압(평균 128/76 mmHg), 인종(90% 백인) 에 있어서 잘 일치했습니다 . 남성은 CAMZYOS 그룹의 54%, 위약 그룹의 65%를 차지했습니다.
기준선에서 무작위로 배정된 환자의 약 73%가 NYHA 2등급이었고 27%가 NYHA 3등급이었습니다.
평균 LVEF는 74%였고 평균 Valsalva LVOT 기울기는 73mmHg였습니다.
약 10%가 이전에 중격 감소 치료를 받았고, 75%가 베타 차단제를 사용했고, 17%가 칼슘 채널 차단제를 사용했고, 14%가 심방 세동의 병력이 있었습니다.
모든 환자는 CAMZYOS 5mg(또는 일치하는 위약)을 매일 한 번 복용하기 시작했으며, 용량은 환자 반응을 최적화(발살바 기동으로 인한 LVOT 기울기 감소)하고 LVEF ≥50%를 유지하기 위해 주기적으로 조절되었습니다.
용량은 또한 CAMZYOS의 혈장 농도에 따라 결정되었습니다.
CAMZYOS 그룹에서 치료 종료 시 환자의 49%가 5mg 용량을, 33%가 10mg 용량을, 11%가 15mg 용량을 투여받고 있었습니다.
3명의 환자가 LVEF <50%로 인해 일시적으로 복용을 중단했고, 그 중 2명은 동일한 용량으로 치료를 재개했고 1명은 10mg에서 5mg으로 용량을 줄였습니다.
1차 종료점
30주차에 평가한 1차 복합 기능적 종료점은 최대 산소 소비량(pVO2)이 ≥1.5 mL/kg/min 향상 되고 NYHA 분류가 최소 1% 향상되거나 pVO2가 ≥3.0 mL/kg/min 향상되고 NYHA 분류가 악화되지 않는 환자의 비율로 정의했습니다.
CAMZYOS 그룹에서 30주차에 1차 종료 지점을 충족한 환자의 비율이 위약 그룹보다 더 높았습니다(각각 37% 대 17%, p=0.0005, 표 2 참조).
|
캠시오스 N (%) 숫자 = 123 |
위약 N (%) 숫자 = 128 |
차이점 (95% 신뢰구간) |
p-값 |
|
|
총 응답자 수 |
45(37%) |
22 (17%) |
19% (9, 30) |
0.0005 |
|
기준선에서의 변경 pVO2 ≥1.5 mL /kg/min 및 NYHA 감소 |
41 (33%) |
18 (14%) |
19% (9, 30) |
|
|
기준선에서의 변경 pVO2 ≥3 mL /kg/min 및 NYHA 증가하지 않음 |
29 (23%) |
14(11%) |
13% (3, 22) |
다양한 인구학적 특성, 기준 질병 특성 및 기준 수반 약물이 결과에 미치는 영향을 조사했습니다.
1차 분석 결과는 분석된 모든 하위 그룹에서 CAMZYOS를 일관되게 선호했습니다(그림 4).
그림 4: 1차 복합 기능적 종료점의 하위 그룹 분석
점선 수직선은 전반적인 치료 효과를 나타내고 실선 수직선(효과 없음)은 치료 그룹 간에 차이가 없음을 나타냅니다.
참고: 위 그림은 다양한 하위 그룹의 효과를 나타내며, 모두 기준 특성입니다.
표시된 95% 신뢰 한계는
수행된
비교 횟수를 고려하지 않으며 다른 모든 요인을 조정한 후 특정 요인의 효과를 반영하지 않을 수 있습니다.
그룹 간의 명백한 동질성 또는 이질성을 과도하게 해석해서는 안 됩니다.
배경 베타 차단제 치료를 받는 환자에서 마바캄텐의 이점은 치료를 받지 않는 환자보다 적었지만(pVO2의 개선 정도 감소 ) , 다른 2차 종료점(증상, LVOT 기울기)에 대한 분석 결과, 환자는 베타 차단제 사용 여부와 관계없이 마바캄텐 치료로 이점을 얻을 수 있는 것으로 나타났습니다.
2차 종료점
CAMZYOS가 LVOT 폐쇄, 기능적 용량 및 건강 상태에 미치는 치료 효과는 운동 후 LVOT 피크 기울기의 기준선에서 30주차까지의 변화, pVO2의 변화 , NYHA 분류에서 개선이 있는 환자의 비율, Kansas City Cardiomyopathy Questionnaire-23(KCCQ-23) 임상 요약 점수(CSS), 비대성 심근증 증상 설문지(HCMSQ) 호흡곤란(SoB) 도메인 점수를 통해 평가했습니다.
30주차에 CAMZYOS를 투여받은 환자는 모든 2차 종료점에서 위약군에 비해 더 큰 개선을 보였습니다(표 3, 그림 5, 그림 6, 표 4 및 그림 7-10).
|
캠시오스 숫자 = 123 |
위약 숫자 = 128 |
차이(95% CI) |
p-값 |
|
|
운동 후 LVOT 기울기(mmHg), 평균 (에스디) |
-47(40) |
-10(30) |
-35 (-43, -28) |
<0.0001 |
|
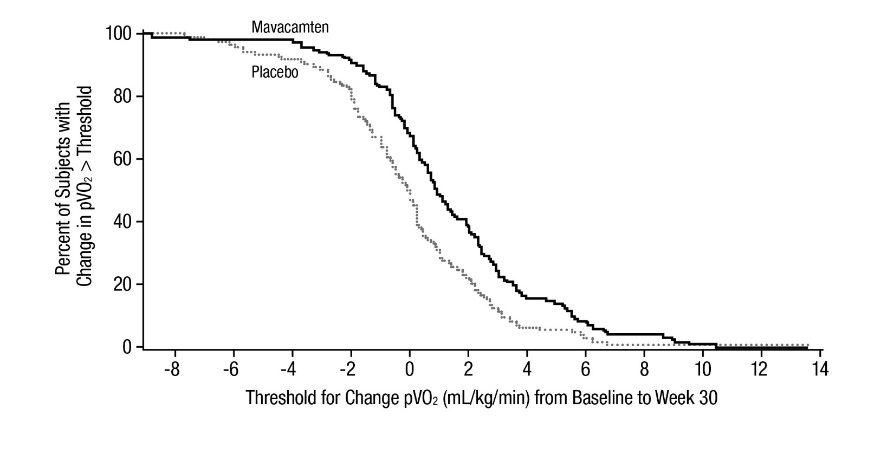
pVO2 (mL/ kg /min), 평균 (에스디) |
1.4 (3.1) |
-0.1 (3.0) |
1.4 (0.6, 2.1) |
<0.0006 |
|
NYHA의 숫자(%) 수업 개선 ≥1 |
80 (65%) |
40(31%) |
34% (22%, 45%) |
<0.0001 |
그림 5: LVOT 피크 기울기에서 기준선에서 30주차까지의 변화의 누적 분포
그림 6: pVO2의 기준선에서 30주차까지의 변화의 누적 분포
|
† KCCQ‑23 CSS는 KCCQ‑23의 Total Symptom Score(TSS)와 Physical Limitations(PL) 점수에서 파생되었습니다. |
|||||
|
기준선, 평균(SD) |
기준선에서 30주차까지의 변화, 평균 (에스디) |
차이점, LS 평균 (95%CI) 및 p-값 |
|||
|
캠시오스 |
위약 |
캠시오스 |
위약 |
||
|
KCCQ‑23 CSS † |
숫자=99 71 (16) |
숫자=97 71 (19) |
14(14) |
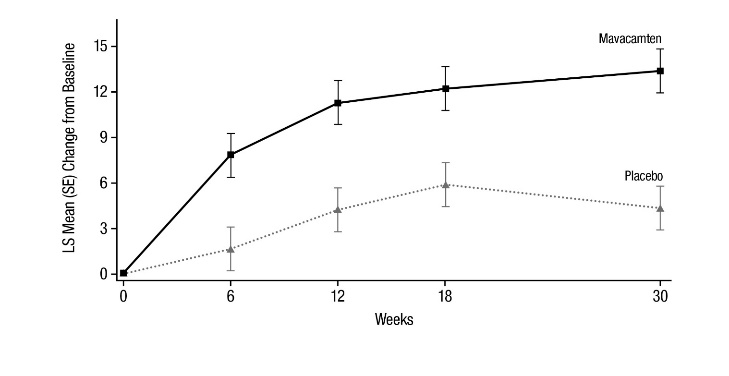
4(14) |
9(5, 13) 유의수준 <0.0001 |
|
KCCQ-23 TSS |
71 (17) |
69 (22) |
12(15) |
5 (16) |
|
|
KCCQ-23 PL |
70(18) |
72(19) |
15 (17) |
4(15) |
|
|
HCMSQ SoB ‡ |
숫자=108 5 (3) |
숫자=109 5 (3) |
-3(3) |
-1 (2) |
-2 (-2, -1) 유의수준 <0.0001 |
그림 7은 KCCQ-23 CSS의 변화에 대한 시간 경과를 보여줍니다.
그림 8은 KCCQ-23 CSS의 기준선에서 30주차까지의 변화 분포를 보여줍니다.
그림 7: KCCQ-23 임상 요약 점수: 시간 경과에 따른 기준선 대비 평균 변화
그림 8: KCCQ-23 임상 요약 점수: 기준선에서 30주차까지의 변화의 누적 분포
그림 9는 HCMSQ SoB의 변화에 대한 시간 경과를 보여줍니다.
그림 10은 HCMSQ SoB의 기준선에서 30주차까지의 변화 분포를 보여줍니다.
그림 9: HCMSQ 호흡곤란 도메인: 시간 경과에 따른 기준선 대비 평균 변화
그림 10: HCMSQ 호흡곤란 도메인: 기준선에서 30주차까지의 변화 누적 분포
발로르-HCM
CAMZYOS의 효능은 112명의 환자(평균 연령 60세, 남성 51%, NYHA III 등급 93%)를 대상으로 CAMZYOS 또는 위약으로 치료를 받도록 1:1로 무작위 배정한 3상 이중 맹검 무작위 16주 위약 대조 시험인 VALOR-HCM에서 평가되었습니다.
기준선에서 모든 환자는 증상이 있는 폐쇄성 HCM이 있었고 SRT 적격자였습니다.
심각한 증상이 있는 약물 내성 폐쇄성 HCM(베타 차단제, 칼슘 채널 차단제 및/또는 디소피라미드의 조합을 사용하는 33% 포함; 디소피라미드 단독 또는 다른 치료와 병용하여 사용하는 20% 포함)과 운동성 실신 또는 실신에 가까운 NYHA 분류 III/IV 또는 분류 II를 가진 환자가 연구에 포함되었습니다.
환자는 휴식 시 또는 도발 시
LVOT
피크 기울기 ≥50 mmHg, LVEF ≥60%를 가져야 했습니다.
환자는 지난 12개월 이내에 SRT를 위해 의뢰되었거나 적극적으로 고려 중이어야 하며 시술 일정을 적극적으로 고려하고 있어야 합니다.
환자들은 CAMZYOS(2.5mg, 5mg, 10mg 또는 15mg) 또는 위약 캡슐을 16주 동안 매일 한 번씩 투여받았습니다.
용량 조절은 임상적 심초음파 매개변수를 기반으로 했습니다.
1차 종료점
CAMZYOS는 16주차에 SRT를 진행하기로 한 환자의 결정(16주차 이전 또는 16주차에 SRT 진행 결정의 합성) 또는 SRT 적격성(LVOT 기울기 ≥ 50 mmHg 및 NYHA 분류 III-IV 또는 운동성 실신 또는 실신에 가까운 경우 분류 II)을 충족한 환자의 비율을 감소시키는 데 있어 위약보다 우수한 것으로 나타났습니다(각각 18% 대 77%, p<0.0001, 표 5 참조).
|
*NYHA III 또는 IV 등급, 또는 운동 유발 실신 또는 실신에 가까운 등급, 휴식 시 또는 자극 시(예: 발살바 또는 운동) 동적 LVOT 경사도 ≥ 50 mmHg인 II 등급. |
||||
|
캠시오스 N (%) 숫자=56 |
위약 N (%) 숫자=56 |
치료의 차이 (95% 신뢰구간) |
p-값 |
|
|
1차 효능 복합 종료점 |
10 (18) |
43 (77) |
59% |
<0.0001 |
|
SRT를 진행하기로 한 환자 결정 |
2 (3.6) |
2 (3.6) |
||
|
가이드라인 기준에 따라 SRT 적격 |
8(14) |
39 (70) |
||
|
SRT 상태 평가 불가( |
0 |
2 (3.6) |
||
2차 종료점
CAMZYOS가 LVOT 폐쇄, 기능적 용량, 건강 상태에 미치는 치료 효과는 기준선에서 16주차까지 운동 후 LVOT 기울기의 변화, NYHA 분류에서 개선을 보인 환자의 비율, KCCQ-23 CSS를 통해 평가되었습니다.
|
† KCCQ-23 CSS는 KCCQ-23의 Total Symptom Score(TSS)와 Physical Limitations(PL) 점수에서 파생되었습니다. |
||||
|
캠시오스 숫자 = 56 |
위약 숫자 = 56 |
차이점 (95% 신뢰구간) |
p-값 |
|
|
운동 후 LVOT 기울기(mmHg), 평균(SD) |
-39 (37) |
-2 (29) |
-38 (-49, -28) |
<0.0001 |
|
NYHA Class가 ≥1 향상된 수(%) |
35 (63%) |
12 (21%) |
41% (25%, 58%) |
<0.0001 |
|
KCCQ-23 CSS † , 평균(SD) |
10 (16) |
2 (12) |
9 (5, 14) |
<0.0001 |
|
| ||||
10
(16)
2
(14)
10
(5, 15)
10
(19)
2
(17)
10
(5, 16)
그림 11은 KCCQ-23 CSS의 변화에 대한 시간 경과를 보여줍니다.
그림 12는 KCCQ-23 CSS에 대한 기준선에서 16주차까지의 변화 분포를 보여줍니다.
그림 11: KCCQ-23 임상 요약 점수: 시간 경과에 따른 기준선 대비 평균 변화
그림 12: KCCQ-23 임상 요약 점수: 기준선에서 16주차까지의 변화의 누적 분포
이 그림은 특정 수준의 반응을 달성한 환자의 누적 백분율을 보여줍니다.
16. Camzyos는 어떻게 공급되나요?
CAMZYOS ® 는
2.5mg, 5mg, 10mg 또는 15mg의 마바캄텐을 함유한 즉시 방출형 2호 경질 젤라틴 캡슐로 공급됩니다.
흰색 불투명 캡슐 본체에는 "Mava"가 각인되어 있으며, 불투명 캡에는 강도가 각인되어 있습니다.
캡슐에는 흰색에서 흰색에 가까운 분말이 들어 있습니다.
CAMZYOS 캡슐은 아래 표에 나열된 대로 30캡슐 병으로 제공됩니다.
|
힘 |
캡슐캡 |
NDC 번호 |
|
2.5mg |
연보라색 |
73625-111-11 |
|
5mg(5mg) |
노란색 |
73625-112-11 |
|
10mg |
분홍색 |
73625-113-11 |
|
15밀리그램 |
회색 |
73625-114-11 |
저장
20°C~25°C(68°F~77°F)에서 보관하고 15°C~30°C(59°F~86°F) 사이의 온도 변화가 허용됩니다 . [USP 관리실 온도 참조]
17. 환자 상담 정보
환자 및/또는 간병인에게 FDA 승인 환자 라벨(약물 가이드)을 읽으라고 조언하세요.
심부전
환자에게 심부전을 모니터링하기 위해 심장초음파를 사용하여 심장 기능 모니터링을 수행해야 한다는 사실을 알립니다 . [ 경고 및 주의사항(5.1) 참조 ] 환자에게 심부전의 징후나 증상이 있으면 즉시 의료 서비스 제공자에게 보고하도록 조언합니다.
약물 상호 작용
환자에게 CAMZYOS 치료 전과 치료 중에 오메프라졸, 에소메프라졸, 시메티딘 등의 일반 의약품과 보충제를 포함한 모든 병용 제품에 대해 의료 서비스 제공자에게 알리도록 조언합니다.
CAMZYOS REMS 프로그램
CAMZYOS는 CAMZYOS REMS 프로그램이라는 제한된 프로그램을 통해서만 사용할 수 있습니다 . [ 경고 및 주의사항(5.3) 참조 ] 환자에게 다음의 주목할 만한 요구 사항을 알리십시오.
CAMZYOS는 인증된 의료 서비스 제공자에 의해서만 처방되고 프로그램에 참여하는 인증된 약국에서만 분배됩니다.
환자에게 제품 구입 방법에 대한 정보를 제공하는 전화번호와 웹사이트를 제공하십시오 [ 경고
및 주의사항(5.3) 참조 ] .
배아-태아 독성
임신 여성 및 생식 잠재력이 있는 여성에게 태아에 대한 잠재적 위험에 대해 알리십시오. 생식 잠재력이 있는 여성에게 알려진 또는 의심되는 임신을 의료 제공자에게 알리도록 알리십시오 [ 경고 및 주의사항(5.4) 및 특정 집단에서의 사용(8.1 , 8.3) 참조 ] .
생식 잠재력이 있는 여성에게 CAMZYOS 치료 중 및 마지막 복용 후 4개월 동안 효과적인 피임법을 사용하도록 조언하십시오.
에티닐에스트라디올과 노르에틴드론의 조합을 함유한 CHC는 마바캄텐과 함께 사용할 수 있습니다.
그러나 CAMZYOS는 특정 다른 복합 호르몬 피임약(CHC)의 효과를 감소시킬 수 있습니다.
이러한 CHC를 사용하는 경우 환자에게 CAMZYOS의 동시 사용 중 및 마지막 복용
후 4개월
동안 비호르몬 피임약(예: 콘돔)을 추가하도록 조언하십시오 [ 약물 상호 작용(7.2) 및 특정 집단에서의 사용(8.3) 참조 ] .
임신 중에 CAMZYOS에 노출된 여성에게 임신 결과를 모니터링하는 임신 안전 연구가 있다고 알리십시오. 이러한 환자에게 1-800-721-5072 또는 www.bms.com으로 Bristol-Myers Squibb에 임신 사실을 보고하도록 권장하십시오.
CAMZYOS 복용 지침
CAMZYOS 캡슐은 통째로 삼켜야 합니다.
환자에게 CAMZYOS 복용을 놓친 경우 그날 가능한 한 빨리 복용하고 다음 예정된 복용량은 다음 날 평소 시간에 복용하도록 조언하십시오. 환자는 같은 날에 두 번 복용해서는 안 됩니다.
마케팅:
Bristol-Myers Squibb Company
Princeton, NJ 08543 USA
CAMZYOS ® 는
Bristol Myers Squibb 계열사인 MyoKardia, Inc.의 상표입니다.
약물 가이드
|
약물 가이드 CAMZYOS ® (캄자이오스) (마바캄텐) 캡슐, 경구용 |
|
|
CAMZYOS에 대해 알아야 할 가장 중요한 정보는 무엇입니까? CAMZYOS는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다. |
심부전은 사망으로 이어질 수 있는 심각한 상태입니다.
의료 제공자가 CAMZYOS에 심장이 어떻게 반응하는지 이해하도록 돕기 위해 첫 번째 복용량을 복용하기 전과 CAMZYOS 치료 중에 심초음파 검사를 받아야 합니다.
심각한 감염이나 불규칙한 심장 박동이 발생하는 사람은 CAMZYOS 치료 중에 심부전 위험이 더 큽니다.
o 호흡곤란
o 다리가 부어오름
o 가슴 통증
o 심장이 두근거리는 느낌(두근거림)
피로
o 급격한 체중 증가
CAMZYOS 치료 전과 치료 중에 처방약과 일반 의약품을 포함하여 복용하는 약물에 대해 의료 서비스 제공자에게 알리십시오.
CAMZYOS REMS 프로그램에 등록하는 방법에 대해 의료 서비스 제공자와 상의하세요. 등록 시 프로그램에 대한 정보를 받게 됩니다.
여기에는 의료 서비스 제공자의 지시에 따라 심초음파검사를 받으러 다시 방문하는 것이 포함됩니다.
귀하의 의료 서비스 제공자는 인증 약국을 찾는 방법에 대한 정보를 제공할 수 있습니다.
지역 약국에서는 CAMZYOS를 구입할 수 없습니다.
부작용에 대한 정보는 "CAMZYOS의 가능한 부작용은 무엇입니까?"를 참조하세요 .
CAMZYOS란 무엇인가요?
CAMZYOS는 증상이 있는 폐쇄성 비대성 심근병(HCM)이 있는 성인을 치료하는 데 사용되는 처방약입니다.
CAMZYOS는 증상과 활동 능력을 개선할 수 있습니다.
CAMZYOS가 어린이에게 안전하고 효과적인지는 알려져 있지 않습니다.
CAMZYOS를 복용하기 전에 의료 서비스 제공자에게 다음을 포함한 모든 건강 상태에 대해 알리십시오.
CAMZYOS는 태아에게 해를 끼칠 수 있습니다.
CAMZYOS 치료 중에 임신하거나 임신했을 수 있다고 생각되면 즉시 의료 제공자에게 알리십시오. 또한 Bristol-Myers Squibb에 1-800-721-5072로 전화하거나 www.bms.com으로 전화하여 임신 사실을 보고할 수도 있습니다.
CAMZYOS 치료 중 효과적인 피임 형태 사용에 대해 의료 서비스 제공자와 상의하세요.
CAMZYOS가 모유로 전달되는지는 알려져 있지 않습니다.
CAMZYOS 치료 중에 아기에게 먹이를 주는 가장 좋은 방법에 대해 의료 제공자와 상의하세요.
CAMZYOS 치료 전과 치료 중에 처방약과 일반 의약품, 비타민, 한방 보충제를 포함하여 복용하는 모든 약물에 대해 의료 서비스 제공자에게 알리십시오 . CAMZYOS를 특정 약물이나 자몽 주스와 함께 복용하면 심부전이 발생할 수 있습니다.
의료 서비스 제공자에게 알리지 않고 약물 복용을 중단하거나 복용량을 변경하거나 새로운 약물을 시작하지 마십시오.
특히 다음과 같은 경우 의료 서비스 제공자에게 알리십시오.
CAMZYOS를 어떻게 복용해야 하나요?
CAMZYOS의 가능한 부작용은 무엇입니까?
CAMZYOS는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
CAMZYOS의 가장 흔한 부작용은 다음과 같습니다: 현기증과 실신(실신).
CAMZYOS의 가능한 부작용은 여기에 전부가 아닙니다.
부작용에 대한 의학적 조언을 받으려면 의사에게 전화하세요. 부작용은 FDA에 1-800-FDA-1088로 보고할 수 있습니다.
또한 1-800-721-5072로 브리스톨-마이어스 스퀴브에 부작용을 보고할 수 있습니다.
CAMZYOS는 어떻게 보관해야 하나요?
CAMZYOS는 68°F~77°F(20°C~25°C)의 실온에서 보관하세요.
CAMZYOS와 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하세요.
CAMZYOS의 안전하고 효과적인 사용에 대한 일반 정보.
약물은 때때로 약물 가이드에 나열된 목적 외의 목적으로 처방됩니다.
CAMZYOS를 처방되지 않은 질환에 사용하지 마십시오. 다른 사람에게 CAMZYOS를 주지 마십시오. 다른 사람이 당신과 같은 증상을 가지고 있더라도 말입니다.
해로울 수 있습니다.
의료 전문가를 위해 작성된 CAMZYOS에
대한 정보는
의료 서비스 제공자나 약사에게 문의할 수 있습니다.
CAMZYOS의 성분은 무엇입니까?
활성 성분: 마바캄텐
비활성 성분: 크로스카멜로스 나트륨, 히프로멜로스, 스테아르산 마그네슘(소 제외), 만니톨, 이산화규소. 캡슐에는 검은 산화철, 젤라틴, 붉은 산화철, 이산화티타늄, 노란 산화철이 들어 있습니다.
마케팅 제공자:
브리스톨-마이어스 스퀴브 회사
프린스턴, 뉴저지 08543 미국
CAMZYOS ® 는
Bristol Myers Squibb 계열사인 MyoKardia, Inc.의 상표입니다.
자세한 내용은 www.CAMZYOS.com을 방문하시거나 1-800-721-5072로 전화해주세요.
이 약물 안내서는 미국 식품의약국에서 승인을 받았습니다.
개정: 04/2024
CAMZYOS 2.5 mg 라벨
NDC 73625-111-11
Rx만
캠죠스 ™
(마바캄텐)
캡슐
2.5mg
첨부된 약물 안내서를 각 환자에게 제공합니다.
권장 복용량: 처방 정보 참조
어린이의 손이 닿지 않는 곳에 보관하세요.
내부 밀봉 병이 파손되었거나 없는 경우 사용하지 마십시오 .
30캡슐
브리스톨 마이어스 스퀴브
CAMZYOS 5 mg 라벨
NDC 73625-112-11
Rx만
캠죠스 ™
(마바캄텐)
캡슐
5mg(5mg)
첨부된 약물 안내서를 각 환자에게 제공합니다.
권장 복용량: 처방 정보 참조
어린이의 손이 닿지 않는 곳에 보관하세요.
내부 밀봉 병이 파손되었거나 없는 경우 사용하지 마십시오 .
30캡슐
브리스톨 마이어스 스퀴브
CAMZYOS 10 mg 라벨
NDC 73625-113-11
Rx만
캠죠스 ™
(마바캄텐)
캡슐
10mg
첨부된 약물 안내서를 각 환자에게 제공합니다.
권장 복용량: 처방 정보 참조
어린이의 손이 닿지 않는 곳에 보관하세요.
내부 밀봉 병이 파손되었거나 없는 경우 사용하지 마십시오 .
30캡슐
브리스톨 마이어스 스퀴브
CAMZYOS 15 mg 라벨
NDC 73625-114-11
Rx만
캠죠스 ™
(마바캄텐)
캡슐
15밀리그램
첨부된 약물 안내서를 각 환자에게 제공합니다.
권장 복용량: 처방 정보 참조
어린이의 손이 닿지 않는 곳에 보관하세요.
내부 밀봉 병이 파손되었거나 없는 경우 사용하지 마십시오 .
30캡슐
브리스톨 마이어스 스퀴브
|
CAMZYOS |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
CAMZYOS |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
CAMZYOS |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
CAMZYOS |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
라벨러 - (주)미오카디아 (078698088) |